Nuvigil: zdravljenje čezmerne zaspanosti (popolne informacije o predpisovanju)
Blagovna znamka: Nuvigil
Splošno ime: armodafinil
Nuvigil® (armodafinil) tablete [C-IV]
Armodafinil je zdravilo, ki spodbuja budnost, ki je na voljo kot zdravilo Nuvigil, ki se uporablja za zdravljenje apneje v spanju, narkolepsije ali motnje delovnega spanja. Uporaba, odmerjanje, stranski učinki.
Vsebina:
Opis
Klinična farmakologija
Kliničnih preskušanj
Indikacije in uporaba
Kontraindikacije
Opozorila
Previdnostni ukrepi
Neželeni učinki
Zloraba drog in odvisnost
Predoziranje
Odmerjanje in uporaba
Kako dobavljeno
Informacije o bolniku Nuvigil (v navadni angleščini)
Opis
NUVIGIL® (armodafinil) je sredstvo za budnost pri peroralni uporabi. Armodafinil je R-enantiomer modafinila, ki je mešanica R- in S-enantiomerov. Kemično ime za armodafinil je 2 - [(R) - (difenilmetil) sulfinil] acetamid. Molekularna formula je C15H15NE2S in molekulska teža je 273,35.
Kemična struktura je:
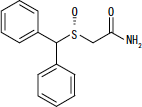
Armodafinil je bel do sivo bel kristalni prah, ki je v vodi zelo slabo topen, slabo topen v acetonu in topen v metanolu. Tablete NUVIGIL vsebujejo 50, 150 ali 250 mg armodafinila in naslednje neaktivne sestavine: kroskarmeloza natrij, laktoza monohidrat, magnezijev stearat, mikrokristalna celuloza, povidon in pregelatinizirani škrob.
vrh
Klinična farmakologija
Mehanizem delovanja in farmakologija
Natančen mehanizem (mehanizmi), s pomočjo katerega armodafinil (R-enantiomer) ali modafinil (mešanica R- in S-enantiomerov) spodbujajo budnost, ni znan. Tako armodafinil kot modafinil imata v podobnih preskušanjih podobne farmakološke lastnosti v nekliničnih študijah na živalih in in vitro.
nadaljevanje zgodbe spodaj
V farmakološko pomembnih koncentracijah armodafinil ne veže ali zavira več receptorjev in encimov, ki so lahko pomembni za uravnavanje spanja / budnosti, vključno s tistimi za serotonin, dopamin, adenozin, galanin, melatonin, melanokortin, oreksin-1, sirotein, PACAP oz. benzodiazepini ali prevozniki za GABA, serotonin, norepinefrin ter holin ali fosfodiesterazo VI, COMT, GABA transaminazo in tirozin hidroksilaza. Modafinil ne zavira aktivnosti MAO-B ali fosfodiesteraze II-IV.
Budnost, ki jo povzroča modafinil, lahko zmanjša antagonist receptorjev ± 1-adrenergičnih receptorjev, prazosin; vendar je modafinil neaktiven v drugih sistemih in vitro preizkušanja, za katere je znano, da so odzivni na Î -adrenergične agoniste, kot je pripravek za vare iz žrela podgane.
Armodafinil ni agonist dopaminskih receptorjev z neposrednim ali posrednim delovanjem. Vendar se in vitro tako armodafinil kot modafinil vežeta na dopaminski transporter in zavirata ponovni vnos dopamina. Za modafinil je bila ta aktivnost in vivo povezana s povečano ravnijo zunajceličnega dopamina v nekaterih možganskih regijah živali. Pri miših z genskim inženiringom, ki jim primanjkuje dopaminskega prenašalca (DAT), modafinil ni imel aktivnosti za spodbujanje budnosti, kar kaže, da je bila ta aktivnost odvisna od DAT. Vendar učinki modafinila, ki spodbuja zbujanje, za razliko od učinkov amfetamina ni antagoniziran od antagonista haloperidola receptorja dopamina pri podganah.
Poleg tega alfa-metil-p-tirozin, zaviralec sinteze dopamina, blokira delovanje amfetamina, vendar ne blokira lokomotorne aktivnosti, ki jo povzroča modafinil.
Armodafinil in modafinil učinkujeta na budnost, podobna simpatomimetikom, vključno z amfetaminom in metilfenidat, čeprav njihov farmakološki profil ni enak tistemu simpatomimetika amini. Modafinil poleg svojih učinkov, ki spodbujajo budnost, in sposobnosti povečanja lokomotorne aktivnosti pri živalih psihoaktivni in evforični učinki, spremembe razpoloženja, dojemanja, razmišljanja in občutkov, značilne za druge stimulanse CNS pri ljudeh. Modafinil ima okrepitvene lastnosti, kar dokazuje njegova samouprava pri opicah, predhodno usposobljenih za samoupravljanje kokaina; modafinil je bil tudi delno diskriminiran kot stimulansu podoben.
Na podlagi nekliničnih študij se zdi, da dva glavna presnovka, kislina in sulfon, modafinil ali armodafinil, ne prispevata k lastnostim matičnih spojin, ki aktivirajo CNS.
Farmakokinetika
Zdravilna učinkovina zdravila NUVIGIL je armodafinil, ki je dolgoživi enantiomer modafinila. NUVIGIL ima linearno časovno neodvisno kinetiko po enkratnem in večkratnem peroralnem odmerjanju. Povečanje sistemske izpostavljenosti je sorazmerno v območju odmerkov od 50 do 400 mg. V 12 tednih odmerjanja ni bilo opaziti nobene časovno odvisne spremembe v kinetiki. Očitno stacionarno stanje zdravila NUVIGIL je doseženo v 7 dneh po odmerjanju. V stanju dinamičnega ravnovesja je sistemska izpostavljenost NUVIGIL-u 1,8-krat večja od izpostavljenosti, ugotovljene po enkratnem odmerku. Profilna koncentracija čistega R-enantiomera po dajanju 50 mg NUVIGIL-a ali 100 mg PROVIGIL-a® (modafinil) so skorajda nadomestljivi.
Absorpcija
Zdravilo NUVIGIL se po peroralni uporabi hitro absorbira. Absolutna peroralna biološka uporabnost ni bila določena zaradi netopnosti vode armodafinila, kar je onemogočilo intravensko dajanje. Najvišje plazemske koncentracije se dosežejo približno 2 uri na tešče. Vpliv hrane na skupno biološko uporabnost zdravila NUVIGIL velja za minimalen; vendar je čas, da dosežemo najvišjo koncentracijo (tmaks) se lahko v stanju hranjenja zavleče za približno 2-4 ure. Ker je zamuda v tmaks je tudi pozneje povišana koncentracija v plazmi, hrana lahko potencialno vpliva na začetek in časovni potek farmakoloških ukrepov za zdravilo NUVIGIL.
Distribucija
NUVIGIL ima navidezen volumen porazdelitve približno 42 L. Podatki, specifični za vezavo proteina armodafinil, niso na voljo. Vendar se modafinil zmerno veže na plazemski protein (približno 60%), predvsem na albumin. Možnost interakcij zdravila NUVIGIL z močno povezanimi proteini velja za minimalen.
Presnova
Podatki in vitro in in vivo kažejo, da je armodafinil podvržen hidrolizni deamidaciji, S-oksidaciji in hidroksilaciji z aromatičnim obročem s poznejšo konjugacijo hidroksiliranih produktov z glukuronidom. Hidroliza amida je najpomembnejša presnovna pot, pri čemer je naslednja pomembna tvorba sulfona v citokromu P450 (CYP) 3A4 / 5. Drugi oksidativni produkti nastajajo prepočasi in vitro, da se omogoči identifikacija odgovornih encimov. Le dva presnovka dosežeta občutne koncentracije v plazmi (t.j. R-modafinilna kislina in modafinil sulfon).
Podatki, specifični za odstranjevanje zdravila NUVIGIL, niso na voljo. Vendar se modafinil izloča predvsem s presnovo, pretežno v jetrih, z manj kot 10% matične spojine se izloči z urinom. V 11 dneh po odmerjanju je bilo odstranjenih 81% uporabljene radioaktivnosti, pretežno z urinom (80% v primerjavi z 1,0% v blatu).
Odprava
Po peroralni uporabi zdravila NUVIGIL je armodafinil očitno monoeksponentno upadel od najvišje plazemske koncentracije. Navidezni terminal t ½ je približno 15 ur. Peroralni očistek zdravila NUVIGIL je približno 33 ml / min.
Interakcije med drogami
Obstoj več poti metabolizma armodafinila, pa tudi dejstvo, da je pot, ki ni povezana s CYP, najhitrejša pri presnovi ardafinfila, kažejo, da obstaja majhna verjetnost vsebinskih učinkov na celoten farmakokinetični profil zdravila NUVIGIL zaradi sočasne inhibicije CYP zdravila.
Podatki in vitro so pokazali, da armodafinil kaže šibek induktivni odziv na CYP1A2 in morda na CYP3A aktivnosti, povezane s koncentracijo in ki jih aktivnost CYP2C19 reverzibilno zavira armodafinil. Zdi se, da armodafinil na druge dejavnosti CYP ni vplival. Študija in vitro je pokazala, da je armodafinil substrat P-glikoproteina.
Kronično dajanje NUVIGIL-a v 250 mg je zmanjšalo sistemsko izpostavljenost midazolamu za 32% in 17% po enkratni peroralni uporabi (5 mg) in intravenski (2 mg) odmerki, kar kaže, da uporaba zdravila NUVIGIL zmerno povzroči CYP3A dejavnost. Za zdravila, ki so substrati za CYP3A4 / 5, kot je ciklosporin, je morda treba prilagoditi odmerjanje. (Glej Previdnostni ukrepi, Interakcije z zdravili).
Kronično dajanje zdravila NUVIGIL v 250 mg ni vplivalo na farmakokinetiko kofeina (200 mg), substrat sonde za aktivnost CYP1A2.
Sočasna uporaba enega samega odmerka 400 mg NUVIGIL-a z omeprazolom (40 mg) je povečala sistemsko izpostavljenost omeprazolu za približno 40%, kar kaže, da armodafinil zmerno zavira CYP2C19 dejavnost. Za zdravila, ki so substrati za CYP2C19, bo morda treba zmanjšati odmerjanje. (Glej Previdnostni ukrepi, Interakcije z zdravili).
Učinek spola
Populacijska farmakokinetična analiza kaže, da spol ne vpliva na farmakokinetiko armodafinila.
Posebne populacije
Podatki, specifični za armodafinil, v posebnih populacijah niso na voljo.
Starostni učinek: V študiji z enim odmerkom pri 200 mg v 12 so opazili rahlo zmanjšanje (~ 20%) peroralnega očistka (CL / F) modafinila. preiskovanci s povprečno starostjo 63 let (razpon od 53 do 72 let), vendar sprememba ni bila klinična pomemben. V študiji z več odmerki (300 mg / dan) pri 12 bolnikih s povprečno starostjo 82 let (razpon 67 - 87 let) je bila povprečna ravni modafinila v plazmi so bile približno dvakrat višje kot v preteklosti dobljenih pri mlajših subjekti. Zaradi možnih učinkov več sočasnih zdravil, s katerimi je bila večina bolnikov Pri zdravljenju očitne razlike v farmakokinetiki modafinila ni mogoče pripisati samo učinkom staranje. Vendar rezultati kažejo, da se očistek modafinila pri starejših lahko zmanjša (Glej Odmerjanje in uporaba).
Učinek dirke: Vpliv rase na farmakokinetiko modafinila ni bil raziskan.
Ledvična okvara: V študiji z enkratnim odmerkom 200 mg modafinila huda kronična odpoved ledvic (očistek kreatinina ‰ mL 20 ml / min) ni pomembno vplivajo na farmakokinetiko modafinila, vendar se je izpostavljenost modafinilna kislina povečala 9-krat (glej Previdnostni ukrepi).
Okvara jeter: Farmakokinetiko in presnovo modafinila so pregledali pri bolnikih s cirozo jeter (6 moških in 3 ženske). Trije bolniki so imeli cirozo stadija B ali B +, 6 pa cirozo stadije C ali C + (po kriterijih za oceno po Child-Pughu). Klinično je bilo 8 od 9 bolnikov ikteričnih in vsi so imeli ascites. Pri teh bolnikih se je peroralni očistek modafinila zmanjšal za približno 60%, koncentracija v stanju dinamičnega ravnovesja pa se je v primerjavi z običajnimi bolniki podvojila. Pri bolnikih s hudo okvaro jeter je treba odmerek zdravila NUVIGIL zmanjšati (glej Previdnostni ukrepi in Odmerjanje in uporaba).
vrh
Kliničnih preskušanj
Učinkovitost zdravila NUVIGIL za izboljšanje budnosti je bila ugotovljena v naslednjem spanju motnje: obstruktivna spalna apneja / sindrom hipopneje (OSAHS), narkolepsija in motnja spalnega dela (SWSD).
Za vsako klinično preskušanje je bila za statistično pomembnost potrebna p-vrednost 0,05 .05.
Sindrom obstruktivne spalne apneje / hipopneje (OSAHS)
Učinkovitost zdravila NUVIGIL pri izboljšanju budnosti pri bolnikih s čezmerno zaspanostjo, povezano z OSAHS, je bila ugotovljena leta 2003 dve 12-tedenski večcentrični, s placebom nadzorovani vzporedni skupini, dvojno slepi študiji ambulant, ki so spoznali mednarodno Merila za razvrstitev motenj spanja (ICSD) za OSAHS (ki so skladna tudi z ameriškim psihiatričnim združenjem) Merila DSM-IV). Ta merila vključujejo bodisi: 1) prekomerno zaspanost ali nespečnost, plus pogoste epizode motenj dihanje med spanjem in s tem povezane lastnosti, kot so glasno smrčanje, jutranji glavoboli ali suha usta prebujanje; ali 2) prekomerna zaspanost ali nespečnost; in polisomnografija, ki prikazuje eno od naslednjega: več kot pet obstruktivnih apnej, vsaka več kot 10 sekund, na uro spanja; in eno ali več od naslednjega: pogosta vzburjenja zaradi spanja, povezana z apnemi, braditahikardijo ali desaturacijo arterijskega kisika v povezavi z apnemi. Poleg tega so morali vsi bolniki imeti prekomerno zaspanost, kot je dokazano z oceno 10 on na lestvici spečnosti Epworth, kljub zdravljenju s stalnim pozitivnim pritiskom v dihalnih poteh (CPAP). Zahtevani so dokazi, da je CPAP učinkovit pri zmanjševanju epizod apneje / hipopneje, skupaj z dokumentacijo o uporabi CPAP.
Bolniki morajo biti v skladu s CPAP, ki je opredeljen kot uporaba CPAP ‰ hours 4 ure / noč na ¥ ¥ 70% nočitev. Uporaba CPAP se je nadaljevala skozi celotno študijo. V obeh študijah so bili glavni ukrepi učinkovitosti 1) latenca spanja, ocenjena s testom vzdrževanja budnosti (MWT) in 2) spremembo bolnikovega celotnega stanja bolezni, merjeno s kliničnim globalnim vtisom sprememb (CGI-C) na koncu obisk. Za uspešno preskušanje sta morala oba ukrepa pokazati statistično pomembno izboljšanje.
MWT meri zamudo (v minutah) za začetek spanja. Razširjena MWT je bila izvedena s preskusnimi sejami v 2-urnih intervalih med 9. in 7. uro. Primarna analiza je bila povprečje zamudnosti spanja med prvimi štirimi testnimi sejami (od 9.00 do 15.00). Za vsako preskusno sejo je bil subjekt prosi, naj ostane buden brez uporabe izrednih ukrepov. Vsako preskusno sejo smo prekinili po 30 minutah, če ni prišlo do spanja ali takoj po začetku spanja. CGI-C je 7-točkovna lestvica, osredotočena na Brez sprememb, in sega od zelo veliko slabšega do zelo izboljšanega. Ocenjevalci niso dobili nobenih posebnih navodil glede meril, ki bi jih morali uporabiti pri ocenjevanju pacientov.
V prvi študiji je bilo skupno 395 bolnikov z OSAHS naključno razporejenih s prejemanjem 150 mg NUVIGIL-a na dan, 250 mg NUVIGIL-ja na dan ali s placebom. Bolniki, zdravljeni z zdravilom NUVIGIL, so pokazali statistično pomembno izboljšanje sposobnosti budnosti v primerjavi s bolniki, ki so prejemali placebo, izmerjeno z MWT ob končnem obisku. Statistično značilno večje število bolnikov, zdravljenih z zdravilom NUVIGIL, je pokazalo izboljšanje splošnega kliničnega stanja, ocenjeno po lestvici CGI-C ob končnem obisku. Povprečne zamude spanja (v minutah) na MWT na izhodišču za preskuse so prikazane v spodnji tabeli, skupaj s povprečno spremembo glede na izhodiščno vrednost na MWT ob končnem obisku. Odstotek bolnikov, ki so se v kliničnih preskušanjih povišali na CGI-C, je prikazan v preglednici 2 spodaj. Dva odmerka zdravila NUVIGIL sta povzročila statistično pomembne učinke podobnih velikosti na MWT in tudi na CGI-C.
V drugi študiji je bilo 263 bolnikov z OSAHS naključno razporejenih z 150 mg NUVIGIL na dan ali s placebom. Bolniki, zdravljeni z zdravilom NUVIGIL, so pokazali statistično pomembno izboljšanje sposobnosti budnosti v primerjavi s bolniki, ki so prejemali placebo, merjeno z MWT [tabela 1]. Statistično značilno večje število bolnikov, zdravljenih z zdravilom NUVIGIL, je pokazalo izboljšanje splošnega kliničnega stanja, ocenjeno po lestvici CGI-C [tabela 2].
V nobeni od študij uporaba NUVIGIL-a na nočno spanje, merjeno s polisomnografijo, ni vplivala.
Narkolepsija
Ugotovljena je bila učinkovitost zdravila NUVIGIL pri izboljšanju budnosti pri bolnikih s čezmerno zaspanostjo (ES), povezanimi z narkolepsijo v eni 12-tedenski večcentrični, s placebom nadzorovani vzporedni skupini, dvojno slepi študiji ambulant, ki so izpolnjevali merila ICSD za narkolepsija. Skupno 196 bolnikov je bilo randomiziranih, da so prejemali 150 ali 250 mg NUVIGIL-a na dan ali s placebom. Merila ICSD za narkolepsijo vključujejo: 1) ponavljajoče se dnevne dremeži ali zamude pri spanju, ki se pojavljajo skoraj vsak dan vsaj tri mesecev plus nenadna dvostranska izguba posturalnega mišičnega tonusa v povezavi z intenzivnimi čustvi (katapleksija) ali 2) pritožba zaradi pretiranega zaspanost ali nenadna mišična oslabelost s povezanimi lastnostmi: paraliza spanja, hipnagogične halucinacije, avtomatsko vedenje, moteno večje epizoda spanja; in polisomnografija, ki dokazujejo eno od naslednjih: latenca spanja manj kot 10 minut ali hitra gibljivost oči (REM) latenca spanja manj kot 20 minut in večkratno spanje Latency Test (MSLT), ki pokaže povprečno zamudo spanja krajše od 5 minut in dve ali več zaporednih REM spanca, brez zdravstvenih ali duševnih motenj simptomi. Za vstop v te študije so morali vsi bolniki objektivno dokumentirati prekomerno dnevno zaspanost prek MSLT z zakasnitvijo spanja 6 minut ali manj in odsotnostjo kakršnih koli drugih klinično pomembnih aktivnih medicinskih ali psihiatričnih motnja. MSLT, objektivna polisomnografska ocena bolnikove zmožnosti zaspanja v an nestimulacijsko okolje, izmerjena zakasnitev (v minutah) za začetek spanja v povprečju na 4 testne seje ob 2-urni intervali. Za vsako preizkusno sejo je bil subjekt rešen, naj mirno leži in poskuša spati. Vsako preskusno sejo smo prekinili po 20 minutah, če ni prišlo do spanja ali takoj po začetku spanja.
Primarni ukrepi učinkovitosti so bili: 1) latenca spanja, ocenjena s testom vzdrževanja budnosti (MWT) in 2) sprememba bolnikove splošne bolezni stanje, merjeno s Kliničnim globalnim vtisom sprememb (CGI-C) na zadnjem obisku (za opis teh podatkov glejte KLINIČNA PRESKUSA, OSAHS zgoraj) ukrepi). Vsaka testna seja MWT se je končala po 20 minutah, če v tej študiji ni bilo spanja ali takoj po začetku spanja.
Bolniki, zdravljeni z zdravilom NUVIGIL, so pokazali statistično značilno povečano sposobnost, da ostane buden na MWT pri vsakem odmerku v primerjavi s placebom ob končnem obisku [tabela 1]. Statistično značilno večje število bolnikov, ki so se zdravili z zdravilom NUVIGIL ob vsakem odmerku, je pokazalo izboljšanje splošnega kliničnega stanja, ocenjeno po lestvici CGI-C ob končnem obisku [tabela 2].
Dva odmerka zdravila NUVIGIL sta povzročila statistično pomembne učinke podobnih velikosti na CGI-C. Čeprav je bil za vsak odmerek opažen statistično pomemben učinek na MWT, je bil opažen obseg učinka pri večjem odmerku.
Uporaba zdravila NUVIGIL na nočni spanec, merjen s polisomnografijo, ni vplivala.
Motnja delovnega spanca Shift (SWSD)
Učinkovitost zdravila NUVIGIL pri izboljšanju budnosti pri bolnikih s prekomerno zaspanostjo SWSD so dokazali v 12-tedenski, večcentrični, dvojno slepi, s placebom nadzorovani, vzporedni skupini sojenje. Skupno 254 bolnikov s kroničnim SWSD je bilo randomiziranih, da so prejemali 150 mg NUVIGIL-a na dan ali placebo. Vsi pacienti so izpolnjevali merila ICSD za kronični SWSD [ki so skladni s kriteriji Ameriškega psihiatričnega združenja DSM-IV za meritve spanja v cirkadianskem ritmu: Shift Work Type]. Ta merila vključujejo 1) bodisi: a) primarno pritožbo zaradi prekomerne zaspanosti ali nespečnosti, ki je časovno povezana z delovnim obdobjem (običajno nočnim delom), se zgodi med fazo običajnega spanja ali b) polisomnografija in MSLT kažeta na izgubo normalnega vzorca spanja-budnosti (t.j. moten kronobiološki ritmičnost); in 2) simptomov ne upošteva nobena druga zdravstvena ali duševna motnja in 3) simptomi ne izpolnjujejo meril za katero koli drugo motnjo spanja, ki povzroča nespečnost ali prekomerno zaspanost (npr. sprememba časovnega pasu [jet lag] sindrom).
Treba je opozoriti, da vsi bolniki s pritožbo na zaspanost, ki se ukvarjajo tudi z izmenskim delom, ne izpolnjujejo meril za diagnozo SWSD. V klinično preskušanje so bili vključeni le pacienti, ki so bili simptomatični vsaj 3 mesece.
Vpisani pacienti so morali delati tudi najmanj 5 nočnih izmenah na mesec in imeti pretirano zaspanost čas njihove nočne izmene (ocena MSLT ‰ ¤ 6 minut) in dnevno nespečnost dokumentira dnevni dnevni polisomnogram (PSG).
Primarni ukrepi učinkovitosti so bili 1) latenca spanja, ocenjena s testom večkratne zakasnitve spanja (MSLT) med simulirano nočno izmeno ob končni obisk in 2) spremembo bolnikovega celotnega stanja bolezni, merjeno s kliničnim globalnim vtisom sprememb (CGI-C) na končnem obisku. (Glej Kliničnih preskušanj, Zgoraj opisani oddelki za narkolepsijo in OSAHS za opis teh ukrepov).
Bolniki, zdravljeni z zdravilom NUVIGIL, so pokazali statistično pomembno podaljšanje časa spanja pojav v primerjavi s bolniki, ki so prejemali placebo, merjeno z nočno MSLT ob končnem obisku [tabela 1]. Statistično značilno večje število bolnikov, zdravljenih z zdravilom NUVIGIL, je pokazalo izboljšanje splošnega kliničnega stanja, ocenjeno po lestvici CGI-C ob končnem obisku [tabela 2].
Uporaba zdravila NUVIGIL ni vplivala na dnevni spanec, merjen s polisomnografijo.
| Nered | Izmerite | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo | |||
* Občutno drugačen od placeba za vsa preskušanja (p <0,05) | |||||||
| Izhodišče | Spremeni se iz osnovne |
Izhodišče | Spremeni se iz osnovne |
Izhodišče | Spremeni se iz Izhodišče |
||
| OSAHS I | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| Narkolepsija | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Nered | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo |
* Občutno drugačen od placeba za vsa preskušanja (p <0,05) | |||
| OSAHS I | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| Narkolepsija | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
vrh
Indikacije in uporaba
Zdravilo NUVIGIL je indicirano za izboljšanje budnosti pri bolnikih s čezmerno zaspanostjo, povezano s sindromom obstruktivne apneje / hipopneje, narkolepsijo in motnjo spalnega dela.
V OSAHS je NUVIGIL označen kot dodatek k standardnemu zdravljenju osnovne ovire. Če je stalni pozitivni tlak v dihalnih poteh (CPAP) izbira za pacienta, je treba pred uvedbo zdravila NUVIGIL vložiti največ truda za zdravljenje s CPAP. Če se NUVIGIL uporablja skupaj s CPAP, je treba spodbujati in občasno ocenjevati skladnost CPAP.
V vseh primerih je izredno pomembna skrbna diagnoza in zdravljenje osnovnih motenj spanja. Naročniki se morajo zavedati, da imajo nekateri pacienti več motenj spanja, kar prispeva k njihovi pretirani zaspanosti.
Učinkovitost zdravila NUVIGIL pri dolgotrajni uporabi (več kot 12 tednov) v placebo nadzorovanih preskušanjih ni bila sistematično ocenjena. Zdravnik, ki se odloči za predpisovanje zdravila NUVIGIL dlje časa pri bolnikih, mora občasno ponovno oceniti dolgoročno uporabnost za posameznega bolnika.
vrh
Kontraindikacije
Zdravilo NUVIGIL je kontraindicirano pri bolnikih z znano preobčutljivostjo za modafinil in armodafinil ali njegove neaktivne sestavine.
vrh
OPOZORILA
Resni izpuščaji, vključno s Stevens-Johnsonovim sindromom
Pri odraslih so poročali o resnih izpuščajih, ki zahtevajo hospitalizacijo in prekinitev zdravljenja v povezavi z uporabo armodafinil ter pri odraslih in otrocih v povezavi z uporabo modafinila, racemične mešanice S in R modafinila (slednji je armodafinil).
Zdravila Armodafinil pri otrocih niso preučevali v nobenem okolju in ni odobren za uporabo pri pediatričnih bolnikih za nobene indikacije.
V kliničnih preskušanjih armodafinila pri odraslih (0 na 1.595) o poročanju o armodafinilu niso poročali o resnih kožnih izpuščajih. Vendar pa so v postmarketinških izkušnjah poročali o primerih resnih izpuščajev pri odraslih. Ker je armodafinil R izomer racemskega modafinila, podobnega tveganja za resne izpuščaje pri pediatričnih bolnikih z armodafinilom ni mogoče izključiti.
V kliničnih preskušanjih modafinila (racemata) je bila incidenca izpuščajev, ki so povzročili ukinitev, približno 0,8% (13 na 1.585) pri otrocih (starost <17 let); ti izpuščaji so vključevali 1 primer možnega Stevens-Johnsonovega sindroma (SJS) in 1 primer očitne reakcije preobčutljivosti z več organi. Več primerov je bilo povezanih z vročino in drugimi nepravilnostmi (npr. Bruhanje, levkopenija). Srednji čas do izpuščaja, ki je privedel do ukinitve, je bil 13 dni. Med 380 pediatričnimi bolniki, ki so prejemali placebo, niso opazili takšnih primerov. V kliničnih preskušanjih za odrasle (0 na 4.264) modafinila niso poročali o resnih kožnih izpuščajih. Redki primeri resnih ali smrtno nevarnih izpuščajev, vključno s SJS, toksično epidermalno nekrolizo (TEN) in izpuščaji z zdravili z Pri odraslih in otrocih so poročali o eozinofiliji in sistemskih simptomih v svetovnih izkušnjah po trženju z modafinilom. Stopnja poročanja TEN in SJS, povezana z uporabo modafinila, za katero je splošno priznano, da je zaradi premajhnega poročanja podcenjena, presega stopnjo pojavnosti v preteklosti. Ocene stopnje pojavnosti teh resnih kožnih reakcij v splošni populaciji se gibljejo med 1 in 2 primeri na milijon let.
Ni znanih dejavnikov, ki bi napovedovali tveganje za pojav ali resnost izpuščaja, povezanega z armodafinilom ali modafinilom. Skoraj vsi primeri resnih izpuščajev, povezanih z armodafinilom ali modafinilom, so se pojavili v 1 do 5 tednih po začetku zdravljenja. Po dolgotrajnem zdravljenju z modafinilom (npr. 3 mesece) so poročali o osamljenih primerih. V skladu s tem se trajanja terapije ne da zanesti kot sredstvo za napovedovanje potencialnega tveganja, ki ga je povzročil prvi pojav izpuščaja.
Čeprav se benigni izpuščaji pojavljajo tudi pri armodafinilu, ni mogoče zanesljivo predvideti, kateri izpuščaji se bodo izkazali za resne. V skladu s tem je treba armodafinil ob prvem znaku izpuščaja običajno ukiniti, razen če izpuščaj očitno ni povezan z zdravili. Prekinitev zdravljenja morda ne bo preprečila, da bi izpuščaj postal življenjsko ogrožen ali trajno onemogočil ali razkrinkal.
Angioedem in anafilaktoidne reakcije
Med 1595 bolniki, ki so se zdravili z ardafodafilom, so opazili resni primer angioedema in en primer preobčutljivosti (z izpuščaji, disfagijo in bronhospazmom). Bolnike je treba opozoriti, da prenehajo z zdravljenjem in nemudoma sporočijo zdravniku kakršne koli znake ali simptomi, ki kažejo na angioedem ali anafilaksijo (npr. otekanje obraza, oči, ustnic, jezika ali larinks; težave pri požiranju ali dihanju; hripavost).
Reakcije preobčutljivosti z več organi
Preobčutljivostne reakcije z več organi, vključno z vsaj eno smrtno izkušnjo v postmarketinški izkušnji, imajo je prišlo v tesni časovni povezavi (srednji čas do odkritja 13 dni: območje 4-33) do začetka modafinil. Podobnega tveganja preobčutljivostnih reakcij več organov z armodafinil ni mogoče izključiti.
Čeprav je bilo poročil omejeno, lahko preobčutljivostne reakcije z več organi povzročijo hospitalizacijo ali smrtno nevarne. Ni znanih dejavnikov, ki bi napovedovali tveganje za pojav ali resnost multi-organskih preobčutljivostnih reakcij, povezanih z modafinilom. Znaki in simptomi te motnje so bili raznoliki; vendar pa se bolniki običajno, čeprav ne izključno, kažejo na vročino in izpuščaje, povezane z vključevanjem drugih organov. Druge pridružene manifestacije so vključevale miokarditis, hepatitis, motnje delovanja jeter, hematološke nepravilnosti (npr. eozinofilija, levkopenija, trombocitopenija), pruritus in astenija. Ker je preobčutljivost več organov v svojem izražanju spremenljiva, se lahko pojavijo drugi simptomi in znaki organskih sistemov, ki jih tu ne opazimo.
Če obstaja sum preobčutljivostne reakcije z več organi, je treba zdravljenje z zdravilom NUVIGIL prekiniti. Čeprav ni primerov, ki bi kazali na navzkrižno občutljivost drugih zdravil, ki proizvajajo ta sindrom, izkušnje z zdravili, povezanimi z preobčutljivostjo za več organov, bi pokazale, da gre za a možnost.
Vztrajna zaspanost
Bolnike z nenormalno stopnjo zaspanosti, ki jemljejo zdravilo NUVIGIL, je treba opozoriti, da se njihova stopnja budnosti morda ne bo vrnila v normalno stanje. Bolnike s čezmerno zaspanostjo, vključno s tistimi, ki jemljejo zdravilo NUVIGIL, je treba pogosto ponovno oceniti stopnjo zaspanosti in, če je primerno, priporočljivo, da se izogibate vožnji ali drugim potencialno nevarnim dejavnost. Naročniki se morajo zavedati tudi, da bolniki ne morejo priznati zaspanosti ali zaspanosti, dokler jih neposredno ne vprašajo o zaspanosti ali zaspanosti med določenimi dejavnostmi.
Psihiatrični simptomi
O bolnikih, ki so se zdravili z modafinilom, so poročali o neželenih izkušnjah psihiatrije. Modafinil in armodafinil (NUVIGIL) sta zelo povezana. Zato naj bi bila incidenca in vrsta psihiatričnih simptomov, povezanih z armodafinilom, podobna incidenci in vrsti teh dogodkov z modafinilom.
Neželeni učinki po trženju, ki so povezani z uporabo modafinila, vključujejo manijo, blodnje, halucinacije, samomorilno idejo in agresijo, nekateri pa so povzročili hospitalizacijo. Številni, vendar ne vsi, pacienti so imeli predhodno psihiatrično anamnezo. En zdrav moški prostovoljec je razvil ideje o referencah, paranoidnih blodnjah in slušnih halucinacijah v povezavi z večkratnimi odmerki modafinila v odmerku 600 mg in pomanjkanjem spanja. 36 ur po ukinitvi drog ni bilo dokazov o psihozi.
V kontrolirani preskusni bazi NUVIGIL so bili vzrok tesnoba, vznemirjenost, živčnost in razdražljivost pogostejša prekinitev zdravljenja pri bolnikih z zdravilom NUVIGIL v primerjavi s placebom (1,2% NUVIGIL in placebo 0.3%). V nadzorovanih študijah NUVIGIL je bila tudi depresija razlog za prekinitev zdravljenja pogosteje pri bolnikih z zdravilom NUVIGIL v primerjavi s placebom (NUVIGIL 0,6% in placebo 0,2%). V kliničnih preskušanjih so opazili dva primera samomora. Bodite previdni, kadar dajemo zdravilo NUVIGIL bolnikom z anamnezo psihoze, depresije ali manije. Če se psihiatrični simptomi razvijejo v povezavi z uporabo zdravila NUVIGIL, razmislite o ukinitvi zdravila NUVIGIL.
vrh
VARNOSTNI UKREPI
Diagnoza motenj spanja
Zdravilo NUVIGIL je treba uporabljati samo pri bolnikih, ki so imeli popolno oceno prekomerne zaspanosti in pri katerih a diagnoza narkolepsije, OSAHS in / ali SWSD je bila postavljena v skladu z diagnostičnimi merili ICSD ali DSM (glej Kliničnih preskušanj). Takšno ocenjevanje običajno obsega popolno anamnezo in fizični pregled, dopolni pa se lahko s testiranjem v laboratorijskih razmerah. Nekateri bolniki imajo lahko več kot eno motnjo spanja, kar prispeva k njihovi čezmerni zaspanosti (npr. OSAHS in SWSD sovpadata pri istem bolniku).
Uporaba CPAP pri bolnikih z OSAHS
V OSAHS je NUVIGIL označen kot dodatek k standardnemu zdravljenju osnovne ovire. Če je stalni pozitivni tlak v dihalnih poteh (CPAP) izbira za pacienta, je treba pred uvedbo zdravila NUVIGIL vložiti največ truda za zdravljenje s CPAP. Če se NUVIGIL uporablja skupaj s CPAP, je treba spodbujati in občasno ocenjevati skladnost CPAP. Sčasoma je bil opazen majhen trend zmanjšanja uporabe CPAP (povprečno znižanje za 18 minut za bolnike, zdravljene z zdravilom NUVIGIL in 6-minutno znižanje za bolnike, ki so prejemali placebo, pri povprečni osnovni uporabi 6,9 ure na noč) v NUVIGIL-u preizkušnje.
Splošno
Čeprav ni dokazano, da NUVIGIL povzroča funkcionalno okvaro, lahko katero koli zdravilo, ki vpliva na osrednje živčevje, spremeni presojo, mišljenje ali motorične sposobnosti. Bolnike je treba opozoriti na upravljanje avtomobila ali drugih nevarnih strojev, dokler niso utemeljeno prepričani, da zdravljenje z zdravilom NUVIGIL ne bo negativno vplivalo na njihovo sposobnost vključevanja v takšno dejavnosti.
Srčnožilni sistem
Zdravila NUVIGIL niso ocenili ali v pomembni meri uporabljali pri bolnikih z nedavnim anamnezo miokardnega infarkta ali nestabilno angino, zato je treba takšne bolnike zdraviti previdno.
V kliničnih študijah zdravila PROVIGIL so znaki in simptomi, vključno z bolečinami v prsih, palpitacijami, dispnejo in prehodno ishemijo Spremembe T-vala na EKG so opazili pri treh osebah v povezavi s prolapsom mitralne zaklopke ali levim prekatom hipertrofija. Priporočljivo je, da se tablete NUVIGIL ne uporabljajo pri bolnikih z anamnezo hipertrofije levega prekata ali v bolniki s prolapsom mitralne zaklopke, ki so že prej prejemali CNS sindrom prolapsa mitralne zaklopke stimulansov. Znaki sindroma prolapsa mitralne zaklopke vključujejo, vendar niso omejeni na ishemične spremembe EKG-ja, bolečino v prsih ali aritmijo. Če se pojavi nov pojav katerega koli od teh simptomov, razmislite o srčni oceni.
Spremljanje krvnega tlaka v kratkotrajnih (¤3 mesecih) kontroliranih preskušanjih je pokazalo le majhno povprečno povečanje povprečnega sistoličnega in diastolični krvni tlak pri bolnikih, ki so prejemali NUVIGIL v primerjavi s placebom (1,2 do 4,3 mmHg pri različnih eksperimentalnih skupine). Nekoliko večji delež bolnikov z zdravilom NUVIGIL je potreboval novo ali povečano uporabo antihipertenzivnih zdravil (2,9%) v primerjavi z bolniki, ki so prejemali placebo (1,8%). Pri bolnikih, ki jemljejo zdravilo NUVIGIL, je morda primerno povečano spremljanje krvnega tlaka.
Bolniki, ki uporabljajo steroidne kontraceptive
Učinkovitost steroidnih kontraceptivov se lahko zmanjša, če se uporablja z zdravilom NUVIGIL in še en mesec po prekinitvi zdravljenja (glejte Previdnostni ukrepi, Interakcije z zdravili). Pri bolnikih, ki se zdravijo z zdravilom NUVIGIL, se priporočajo alternativne ali sočasne metode kontracepcije in še en mesec po prekinitvi zdravljenja z zdravilom NUVIGIL.
Bolniki, ki uporabljajo ciklosporin
Ravni ciklosporina v krvi se lahko zmanjšajo, če ga uporabljate z NUVIGIL (glejte Previdnostni ukrepi, Interakcije z zdravili). Ob sočasni uporabi teh zdravil je treba upoštevati spremljanje koncentracije ciklosporina v obtoku in ustrezno prilagoditev odmerka ciklosporina.
Bolniki s hudo okvaro jeter
Pri bolnikih s hudo okvaro jeter, s cirozo ali brez nje (Glej Klinična farmakologija), NUVIGIL je treba dajati v zmanjšanem odmerku (Glej Odmerjanje in uporaba).
Bolniki s hudo okvaro ledvic
Za določitev varnosti in učinkovitosti odmerjanja pri bolnikih s hudo ledvično okvaro ni zadostnih informacij (o farmakokinetiki pri okvari ledvic glejte Klinična farmakologija).
Starejši bolniki
Pri starejših bolnikih se lahko zaradi staranja zmanjša izločanje armodafinila in njegovih presnovkov. Zato je treba pri tej populaciji upoštevati uporabo nižjih odmerkov (glej Klinična farmakologija in Odmerjanje in uporaba).
Informacije za bolnike
Zdravnikom svetujemo, da se z bolniki, ki jim predpišejo zdravilo NUVIGIL, pogovorijo o naslednjih težavah.
Zdravilo NUVIGIL je indicirano za bolnike z nenormalno stopnjo zaspanosti. Pokazalo se je, da NUVIGIL izboljšuje, vendar ne odpravlja te nenavadne nagnjenosti k zaspanju. Zato pacienti ne smejo spreminjati svojega prejšnjega vedenja v zvezi s potencialno nevarnimi dejavnostmi (npr. Vožnja, upravljanje strojev) ali drugimi dejavnosti, ki zahtevajo primerno stopnjo budnosti, dokler in razen če se pokaže, da zdravljenje z zdravilom NUVIGIL povzroči stopnjo budnosti, ki to omogočajo dejavnosti. Bolnike moramo opozoriti, da NUVIGIL ne nadomešča spanja.
Bolnike je treba obvestiti, da je lahko ključnega pomena, da nadaljujejo s predhodno predpisanimi zdravljenji (npr. Bolniki z OSAHS, ki prejemajo CPAP, naj to še naprej izvajajo).
Bolnike je treba obvestiti o razpoložljivosti z navodili za bolnike in jim naročiti, naj preberejo navodilo, preden vzamejo zdravilo NUVIGIL. Glej informacije o bolniku na koncu te etikete za besedilo navodila za paciente.
Bolnike je treba opozoriti, naj se obrnejo na svojega zdravnika, če se pojavijo izpuščaji, depresija, tesnoba ali znaki psihoze ali manije.
Nosečnost
Bolnike je treba opozoriti, naj obvestijo svojega zdravnika, če med zdravljenjem zanosijo ali nameravajo zanositi. Bolnike je treba opozoriti na morebitno povečano tveganje za nosečnost pri uporabi steroidnih kontraceptivov (vključno z depojem ali vsaditvijo kontracepcijskih sredstev) z NUVIGIL-om in še en mesec po prekinitvi zdravljenja (glejte karcinogeneza, mutageneza, oslabitev plodnosti in Nosečnost).
Negovanje
Bolnike je treba opozoriti, naj obvestijo svojega zdravnika, če dojijo dojenčka.
Sočasno zdravljenje z zdravili
Bolnike je treba opozoriti, naj obvestijo svojega zdravnika, če jemljejo ali načrtujejo jemanje zdravila na recept ali brez recepta zaradi možnosti interakcij med zdravilom NUVIGIL in druga zdravila.
Alkohol
Bolnike moramo opozoriti, da uporabe zdravila NUVIGIL v kombinaciji z alkoholom niso preučevali. Bolnike moramo opozoriti, da je med jemanjem zdravila NUVIGIL previdno, da se izogibajo alkoholu.
Alergijske reakcije
Bolnike je treba opozoriti, naj prenehajo jemati zdravilo NUVIGIL in obvestiti zdravnika, če se pojavijo izpuščaji, koprivnica, ustnice, mehurji, luščenje kože, težave s požiranjem ali dihanjem ali s tem povezane alergike pojav.
Interakcije z zdravili
Potencialne interakcije z zdravili, ki zavirajo, povzročajo ali presnavljajo izoencimi citokroma P450 in drugi jetrni encimi
Zaradi delne udeležbe encimov CYP3A pri presnovnem izločanju armodafinila je pri sočasni uporabi močnih induktorjev CYP3A4 / 5 (npr. karbamazepin, fenobarbital, rifampin) ali zaviralci CYP3A4 / 5 (npr. ketokonazol, eritromicin) lahko spremenijo plazemske ravni armodafinil.
Potencial NUVIGIL za spremembo presnove drugih zdravil z indukcijo ali inhibicijo encima
Zdravila, ki jih presnavlja CYP1A2: Podatki in vitro so pokazali, da armodafinil kaže šibek induktivni odziv na CYP1A2 in morda na CYP3A aktivnosti na koncentraciji in pokazali, da aktivnost CYP2C19 reverzibilno zavira armodafinil. Vendar v študiji medsebojnega delovanja s kofeinom klinično niso opazili učinka na aktivnost CYP1A2 (glej Klinična farmakologija, Farmakokinetika, interakcije med zdravili).
Zdravila, ki se presnavljajo s CYP3A4 / 5 (npr. Ciklosporin, etinil estradiol, midazolam in triazolam): Kronično dajanje zdravila NUVIGIL je povzročilo zmerno indukcijo aktivnosti CYP3A. Torej, učinkovitost zdravil, ki so substrati za encime CYP3A (npr. Ciklosporin, etinil estradiol, midazolam in triazolam) se lahko zmanjšajo po začetku sočasnega zdravljenja z NUVIGIL. Pri sočasnem jemanju armodafinila z midazolamom so opazili 32-odstotno zmanjšanje sistemske izpostavljenosti peroralnega midazolama. Morda bo potrebna prilagoditev odmerka (glej Klinična farmakologija, Farmakokinetika, interakcije med zdravili). Takšni učinki (zmanjšane koncentracije) so bili opaženi tudi pri sočasni uporabi modafinila s ciklosporinom, etinilestradiolom in triazolamom.
Zdravila, ki se presnavljajo s CYP2C19 (npr. Omeprazol, diazepam, fenitoin in propranolol): Uporaba zdravila NUVIGIL je povzročila zmerno inhibicijo aktivnosti CYP2C19. Zato je morda potrebno sočasno znižanje odmerka za nekatera zdravila, ki so substrati za CYP2C19 (npr. Fenitoin, diazepam in propranolol, omeprazol in klomipramin), kadar se uporabljajo hkrati z zdravilom NUVIGIL. Pri sočasnem jemanju armodafinila z omeprazolom so opazili 40-odstotno povečanje izpostavljenosti. (Glej Klinična farmakologija, Farmakokinetika, interakcije med zdravili).
Interakcije s CNS Active droge
Podatki, specifični za potencial interakcije med zdravili armodafinil in aktivnimi zdravili CNS, niso na voljo. Naslednje razpoložljive informacije o interakciji med zdravili in zdravili o modafinilu pa bi morale veljati za armodafinil (Glej Opis in Klinična farmakologija).
Sočasno dajanje modafinila z metilfenidatom ali dekstroamfetaminom ni povzročilo pomembnih sprememb na farmakokinetični profil modafinila ali katerega koli od stimulansov, čeprav se je absorpcija modafinila zavlekla za približno eno uro.
Sočasni modafinil ali klomipramin nista spremenila profila PK nobenega od zdravil; vendar so pri bolniku z narkolepsijo med zdravljenjem z modafinilom poročali o enem primeru zvišane ravni klomipramina in njegovega aktivnega presnovka desmetil-klomipramina.
Podatki, specifični za potencial interakcije med zdravilom armodafinil ali modafinil z zaviralci monoamin oksidaze (MAO), niso na voljo. Zato je potrebna previdnost pri sočasni uporabi zaviralcev MAO in zdravila NUVIGIL.
Interakcije z drugimi drogami
Podatki, specifični za potencial interakcije med drugimi zdravili armodafinil, niso na voljo. Naslednje razpoložljive informacije o interakciji med zdravili in zdravili o modafinilu pa bi morale veljati za armodafinil.
Warfarin - Sočasno jemanje modafinila z varfarinom ni prineslo pomembnih sprememb v farmakokinetičnih profilih R- in S-varfarina. Ker pa je bil v tej študiji testiran le en odmerek varfarina, farmakodinamične interakcije ni mogoče izključiti. Zato je treba pogosteje spremljati čas protrombina / INR, kadar je NUVIGIL sočasno uporabljen z varfarinom.
Kancerogeneza, mutageneza, oslabitev plodnosti
Kancerogeneza
Študije karcinogenosti niso bile opravljene samo z armodafinilom. Izvedene so bile raziskave kancerogenosti, v katerih je bil modafinil v prehrani dajen mišem 78 tednov in podganim 104 tedne v odmerkih 6, 30 in 60 mg / kg / dan. Najvišji preučeni odmerek predstavlja 1,5 (miš) ali 3 (podgana) krat večji od priporočenega dnevnega odmerka modafinila (200 mg) za odrasle osebe na osnovi mg / m2. V teh študijah ni bilo dokazov o tumorigenezi, povezani z dajanjem modafinila. Ker pa je raziskava na miših uporabila neustrezno visok odmerek, ki ni reprezentativni za največji tolerančni odmerek, je bila na Tg izvedena kasnejša študija rakotvornosti. AC transgena miška. Odmerki, ocenjeni v Tg. Preizkus AC je bil 125, 250 in 500 mg / kg / dan, vneto dermalno. Ni bilo dokazov o tumorigenosti, povezani z dajanjem modafinila; vendar ta dermalni model morda ne bo ustrezno ocenil kancerogenega potenciala peroralno danega zdravila.
Mutageneza
Armodafinil je bil ovrednoten z in vitro testom bakterijske povratne mutacije in in vitro testom kromosomske aberacije sesalcev pri človeških limfocitih. Armodafinil je bil v teh preskusih negativen, tako v odsotnosti kot tudi pri presnovni aktivaciji.
Modafinil ni pokazal nobenega mutagenega ali klastogenega potenciala v seriji in vitro (tj. Test bakterijske reverzne mutacije, test mišjega limfoma tk, kromosomska aberacija test na človeške limfocite, test celične transformacije v celicah mišjih zarodkov BALB / 3T3) v odsotnosti ali prisotnosti metabolične aktivacije ali in vivo (mikronukleus mišičnega kostnega mozga mišje) analize. Modafinil je bil negativen tudi pri nenačrtovanem testu sinteze DNA v hepatocitih podgane.
Oslabitev plodnosti
Študija plodnosti in zgodnjega embrionalnega razvoja (do implantacije) ni bila opravljena samo z armodafinilom.
Peroralno dajanje modafinila (odmerki do 480 mg / kg / dan) pri podganah samcev in samk pred in čez parjenje in nadaljevanje pri samicah do sedmega dne gestacije je povzročilo, da se je čas parjenja najvišji odmerek; na druge plodnostne ali reproduktivne parametre niso opazili učinkov. Odmerek brez učinka 240 mg / kg / dan je bil povezan z izpostavljenostjo modafinilu v plazmi (AUC), približno enako kot pri ljudeh pri priporočenem odmerku 200 mg.
Nosečnost
Nosečnost kategorija C.
V študijah, izvedenih na podganah (armodafinil, modafinil) in zajcih (modafinil), so opazili razvojno toksičnost pri klinično pomembnih izpostavljenostih.
Peroralno dajanje armodafinila (60, 200 ali 600 mg / kg / dan) nosečim podganam v celotnem obdobju organogeneze je povzročilo povečano pojavnost visceralnih in skeletnih sprememb ploda pri vmesnem odmerku ali večja in manjša teža ploda pri največji odmerek. Odmerek brez učinka na toksičnost za razvoj embriofetalnih podgan je bil povezan s plazemskim armodafinilom izpostavljenost (AUC) približno 0,03-krat večja od AUC pri ljudeh pri največjem priporočenem dnevnem odmerku 250 mg.
Modafinil (50, 100 ali 200 mg / kg / dan), ki se daje oralno nosečim podganam v celotnem obdobju povzročene organogeneze, če ni strupenost za mater, povečanje resorpcij in povečana pojavnost visceralnih in skeletnih sprememb pri potomcih pri najvišjih odmerek. Višji odmerek brez učinka na toksičnost za razvoj embriofetalnih podgan je bil povezan s plazmo izpostavljenost modafinilu, približno 0,5-kratna AUC pri ljudeh pri priporočenem dnevnem odmerku (RHD) 200 mg. Vendar pa v kasnejši študiji do 480 mg / kg / dan (plazemska izpostavljenost modafinilu, približno 2-krat večja od AUC pri ljudeh pri RHD) niso opazili škodljivih učinkov na razvoj zarodkov.
Modafinil, ki se daje oralno nosečim kuncem v celotnem obdobju organogeneze v odmerkih do 100 mg / kg / dan (plazemski AUC modafinil v plazmi, približno enak AUC pri ljudeh pri RHD) ni vplival na embriofetal razvoj; vendar so bili uporabljeni odmerki prenizki, da bi lahko ustrezno ocenili učinke modafinila na razvoj zarodka. V nadaljnji študiji toksičnosti za razvoj, v kateri so ocenili odmerke 45, 90 in 180 mg / kg / dan pri nosečnicah pri kuncih so se povečale pojavnosti strukturnih sprememb ploda in smrt zarodkov odmerek. Najvišji odmerek brez učinka na toksičnost za razvoj je bil povezan z AUC modafinila v plazmi, približno enakega AUC pri ljudeh pri RHD.
Dajanje modafinila podganom v obdobju brejosti in laktacije pri peroralnih odmerkih do 200 mg / kg / dan je povzročilo zmanjšanje sposobnost preživetja potomcev pri odmerkih, večjih od 20 mg / kg / dan (plazemski AUC modafinil približno 0,1-krat večji od AUC pri ljudeh pri RHD). Pri preživelih potomcih niso opazili učinkov na poporodni razvojni in nevrobehevioralni parametri.
Ni primernih in dobro nadzorovanih študij niti armodafinila niti modafinila pri nosečnicah. V povezavi z armodafinilom in modafinilom so poročali o dveh primerih intrauterine zastoja rasti in enem primeru spontanega splava. Čeprav farmakologija armodafinila ni identična tisti s simpatomimetičnimi amini, ima s tem razredom nekatere farmakološke lastnosti. Nekatera od teh zdravil so bila povezana z intrauterino zastojjo rasti in spontanimi splavi. Ali so primeri poročanja z armodafinil povezani z zdravili, ni znano.
Armodafinil ali modafinil je treba uporabljati med nosečnostjo le, če potencialna korist upravičuje potencialno tveganje za plod.
Delo in dostava
Vpliv armodafinila na porod in porod pri ljudeh ni sistematično raziskan.
Doječe matere
Ni znano, ali se armodafinil ali njegovi presnovki izločajo v materino mleko. Ker se v materino mleko izloča veliko zdravil, je pri zdravljenju doječe ženske potrebna previdnost.
Uporaba pri otrocih
Varnost in učinkovitost uporabe armodafinila pri osebah, mlajših od 17 let, nista bili ugotovljeni. Pri otrocih, ki so prejemali modafinil, so opazili resne izpuščaje
Geiratrična uporaba
Varnost in učinkovitost pri osebah, starejših od 65 let, nista bili ugotovljeni.
vrh
Neželeni učinki
Armodafinil je bil ocenjen za varnost pri več kot 1100 bolnikih s čezmerno zaspanostjo, povezano s primarnimi motnjami spanja in budnosti. V kliničnih preskušanjih so ugotovili, da se zdravilo NUVIGIL na splošno dobro prenaša, večina neželenih izkušenj pa je bila blaga do zmerna.
V placebo nadzorovanih kliničnih študijah so najpogosteje opaženi neželeni učinki (‰ ¥ 5%), povezani z uporabo zdravila NUVIGIL, ki se pojavlja pogosteje kot pri bolnikih, ki so prejemali placebo, so bili glavobol, slabost, omotica in nespečnost. Profil neželenih dogodkov je bil v študijah podoben.
V placebo nadzorovanih kliničnih preskušanjih je bilo 44 od 645 bolnikov (7%), ki so prejemali NUVIGIL, prenehali zaradi škodljivih izkušenj v primerjavi s 16 od 445 (4%) bolnikov, ki so prejemali placebo. Najpogostejši razlog za ukinitev je bil glavobol (1%).
Incidenca v kontroliranih preskušanjih
Naslednja tabela (tabela 3) prikazuje neželene izkušnje, ki so se pojavljale s stopnjo 1% ali več in jih je bilo več pogostejši pri bolnikih, zdravljenih z zdravilom NUVIGIL, kot pri bolnikih, ki so prejemali placebo v kliničnih preskušanjih s placebom.
Predpisani zdravnik se mora zavedati, da spodnjih številk ni mogoče uporabiti za napovedovanje pogostnosti neželenih izkušenj potek običajne zdravstvene prakse, kjer se lahko značilnosti pacientov in drugi dejavniki razlikujejo od tistih, ki se pojavijo med klinično študije. Prav tako omenjene frekvence ni mogoče neposredno primerjati s podatki, pridobljenimi iz drugih kliničnih raziskav, ki vključujejo različna zdravljenja, uporabe ali preiskovance. Pregled teh pogostnosti pa predpisovalcem daje podlago za oceno sorazmernega prispevka dejavnikov zdravil in drugih zdravil k pogostnosti neželenih učinkov v preučevani populaciji.
| Sistem organskih razredov MedDRA prednostni izraz |
Nuvigil (Odstotek, N = 645) |
Placebo (Odstotek, N = 445) |
ª štiri dvojno slepe, s placebom nadzorovane klinične študije SWSD, OSAHS in narkolepsije; pojavnost se zaokroži na najbližji celoten odstotek. Vključeni so samo tisti dogodki, pri katerih je pojavnost zdravila Nuvigil večja kot pri placebu. | ||
| Srčne motnje | ||
| Palpitacije | 2 | 1 |
| Bolezni prebavil | ||
| Slabost | 7 | 3 |
| Driska | 4 | 2 |
| Suha usta | 4 | 1 |
| Dispepsija | 2 | 0 |
| Bolečine v trebuhu Zgornje | 2 | 1 |
| Zaprtje | 1 | 0 |
| Bruhanje | 1 | 0 |
| Ohlapni stolčki | 1 | 0 |
| Splošne motnje in pogoji na spletnem mestu uprave | ||
| Utrujenost | 2 | 1 |
| Žeja | 1 | 0 |
| Gripi podobna bolezen | 1 | 0 |
| Bolečina | 1 | 0 |
| Pireksija | 1 | 0 |
| Bolezni imunskega sistema | ||
| Sezonska alergija | 1 | 0 |
| Preiskave | ||
| Zvišana gama-glutamiltransferaza | 1 | 0 |
| Povečan srčni utrip | 1 | 0 |
| Motnje presnove in prehrane | ||
| Anoreksija | 1 | 0 |
| Znižani apetit | 1 | 0 |
| Bolezni živčnega sistema | ||
| Glavobol | 17 | 9 |
| Omotičnost | 5 | 2 |
| Motnja v pozornosti | 1 | 0 |
| Tremor | 1 | 0 |
| Migrena | 1 | 0 |
| Parestija | 1 | 0 |
| Psihiatrične motnje | ||
| Nespečnost | 5 | 1 |
| Anksioznost | 4 | 1 |
| Depresija | 2 | 0 |
| Vznemirjenost | 1 | 0 |
| Živčnost | 1 | 0 |
| Depresivno razpoloženje | 1 | 0 |
| Bolezni ledvic in sečil | ||
| Poliurija | 1 | 0 |
| Dihalne, torakalne in mediastinalne motnje | ||
| Dispneja | 1 | 0 |
| Bolezni kože in podkožja | ||
| Izpuščaj | 2 | 0 |
| Obrnite se na dermatitis | 1 | 0 |
| Hiperhidroza | 1 | 0 |
Odvisnost odmerka neželenih učinkov
V s placebom nadzorovanih kliničnih preskušanjih, ki so primerjale odmerke 150 mg na dan in 250 mg Nuvigila na dan in placebo, edini neželeni učinki, ki so bili odvisno od odmerka, so bili glavobol, izpuščaji, depresija, suha usta, nespečnost in slabost.
ª Štiri dvojno slepe, s placebom nadzorovane klinične študije SWSD, OSAHS in narkolepsije. | ||||
| Sistem organskih razredov MedDRA prednostni izraz |
Nuvigil 250 mg (Odstotek, N = 198) |
Nuvigil 150 mg (Odstotek, N = 447) |
Nuvigil Kombinirano (Odstotek, N = 645) |
Placebo (Odstotek, N = 445) |
|---|---|---|---|---|
| Bolezni prebavil | ||||
| Slabost | 9 | 6 | 7 | 3 |
| Suha usta | 7 | 2 | 4 | <1 |
| Bolezni živčnega sistema | ||||
| Glavobol | 23 | 14 | 17 | 9 |
| Psihiatrične motnje | ||||
| Nespečnost | 6 | 4 | 5 | 1 |
| Depresija | 3 | 1 | 2 | <1 |
| Bolezni kože in podkožja | ||||
| Izpuščaj | 4 | 1 | 2 | <1 |
Spremembe vitalnega znaka
V nadzorovanih preskušanjih je prišlo do majhnih, a konstantnih zvišanj povprečnih vrednosti srednjega sistolnega in diastoličnega krvnega tlaka (glej Previdnostni ukrepi). V nadzorovanih preskušanjih je bilo majhno, a dosledno povprečno povečanje stopnje pulza v primerjavi s placebom. To povečanje se je gibalo od 0,9 do 3,5 BPM.
Laboratorijske spremembe
V študijah so spremljali parametre klinične kemije, hematologije in analize urina. Po uporabi NUVIGIL-a so bile povprečne plazemske ravni gama glutamiltransferaze (GGT) in alkalne fosfataze (AP) višje, vendar ne placeba. Vendar je bilo pri malo preiskovancih zvišanje GGT ali AP zunaj običajnega območja. Razlike v alanin aminotransferazi, aspartat aminotransferazi, skupnih beljakovinah niso bile opažene, albumin ali skupni bilirubin, čeprav so bili redki primeri izoliranega zvišanja AST in / ali ALT. Po 35-dnevnem zdravljenju so opazili en primer blage pancitopenije in rešili z ukinitvijo zdravil. V kliničnih preskušanjih so opazili majhno povprečno znižanje vrednosti sečne kisline v serumu v primerjavi s placebom. Klinični pomen te ugotovitve ni znan.
Spremembe EKG-ja
V kliničnih preskušanjih, nadzorovanih s placebom, nobenemu vzorcu nepravilnosti EKG ni mogoče pripisati uporabe zdravila NUVIGIL.
vrh
Zloraba drog in odvisnost
Razred nadzorovanih snovi
Armodafinil (NUVIGIL) je nadzorovana snov iz seznama IV.
Zloraba potenciala in odvisnosti
Čeprav potencial zlorabe armodafinila ni posebej raziskan, je njegov potencial za zlorabo verjetno podoben kot modafinil (PROVIGIL). Modafinil pri ljudeh povzroča psihoaktivne in evforične učinke, spremembe razpoloženja, zaznave, razmišljanja in občutkov, značilne za druge stimulanse CNS. V študijah vezave in vitro se modafinil veže na mesto ponovnega privzema dopamina in povzroči povečanje zunajceličnega dopamina, ne pa povečanja sproščanja dopamina. Modafinil se krepi, kar dokazuje njegova samouprava pri opicah, ki so se predhodno usposobile za samoupravljanje kokaina. V nekaterih študijah je bil modafinil tudi delno diskriminiran kot stimulans. Zdravniki morajo natančno spremljati bolnike, zlasti tiste z zgodovino zlorabe drog in / ali stimulansov (npr. Metilfenidata, amfetamina ali kokaina). Bolnike je treba opazovati zaradi znakov zlorabe ali zlorabe (npr. Povečanja odmerkov ali vedenja, ki iščejo zdravilo).
Potencial zlorabe modafinila (200, 400 in 800 mg) je bil ocenjen glede na metilfenidat (45 in 90 mg) v bolnišnični študiji pri posameznikih, ki so imeli zlorabo drog. Rezultati te klinične študije so pokazali, da modafinil povzroča psihoaktivne in evforične učinke in občutke, ki so skladni z drugimi načrtovanimi stimulansi CNS (metilfenidat).
vrh
Predoziranje
Človeška izkušnja
V kliničnih študijah NUVIGIL niso poročali o prevelikem odmerjanju. Simptomi prevelikega odmerjanja zdravila NUVIGIL so verjetno podobni kot pri modafinilu. Preveliko odmerjanje v kliničnih preskušanjih modafinila je vključevalo vzbujanje ali vznemirjenost, nespečnost in rahlo ali zmerno zvišanje hemodinamičnih parametrov. Iz izkušenj z zdravilom na trgu, ki je imel zdravilo modafinil, ni bilo poročil o smrtnih prevelikih odmerkih, ki vključujejo samo modafinil (odmerki do 12 gramov). Preveliko odmerjanje več zdravil, vključno z modafinilom, je imelo smrtne izide. Vključeni so simptomi, ki najpogosteje spremljajo preveliko odmerjanje modafinila, samo ali v kombinaciji z drugimi zdravili; nespečnost; simptomi centralnega živčnega sistema, kot so nemir, dezorientacija, zmedenost, vznemirjenje in halucinacija; prebavne spremembe, kot sta slabost in driska; in kardiovaskularne spremembe, kot so tahikardija, bradikardija, hipertenzija in bolečine v prsih.
Obvladovanje prevelikega odmerjanja
Za toksične učinke prevelikega odmerjanja NUVIGIL ni specifičnega protistrupa. Takšna prevelika odmerjanja je treba obvladovati predvsem s podporno nego, vključno s srčno-žilnim nadzorom. Če ni kontraindikacij, je treba upoštevati inducirano bruhanje ali izpiranje želodca. Ni podatkov, ki bi nakazovali na koristnost dialize ali zakisanja ali alkalizacije urina za izboljšanje izločanja zdravil. Zdravnik mora razmisliti, da se za zdravljenje morebitnega prevelikega odmerka obrne na center za nadzor strupov.
vrh
Odmerjanje in uporaba
Sindrom obstruktivne spalne apneje / hipopneje (OSAHS) in narkolepsija
Priporočeni odmerek zdravila NUVIGIL za bolnike z OSAHS ali narkolepsijo je 150 mg ali 250 mg, ki ga dajemo kot en odmerek zjutraj. Pri bolnikih z OSAHS se odmerki do 250 mg / dan, dani kot en odmerek, dobro prenašajo, vendar ni doslednih dokazov, da ta odmerek prinaša dodatne koristi, ki presegajo odmerek 150 mg / dan (glej Klinična farmakologija in Kliničnih preskušanj).
Motnja delovnega spanca Shift (SWSD)
Priporočeni odmerek zdravila NUVIGIL za bolnike s SWSD je 150 mg dnevno, približno 1 uro pred začetkom delovne izmene.
Upoštevati je treba prilagoditev odmerjanja za sočasna zdravila, ki so substrati za CYP3A4 / 5, kot so steroidni kontraceptivi, triazolam in ciklosporin (glejte PREVIDNOSTI, Interakcije z zdravili).
Zdravila, ki se večinoma izločijo s presnovo CYP2C19, na primer diazepam, propranolol in fenitoin, lahko dolgotrajno izločanje po sočasni uporabi z zdravilom NUVIGIL in lahko zahteva zmanjšanje odmerka ter spremljanje toksičnosti (Glej Previdnostni ukrepi, Interakcije z zdravili).
Pri bolnikih s hudo jetrno okvaro je treba zdravilo NUVIGIL dajati v zmanjšanem odmerku (Glej Klinična farmakologija in Previdnostni ukrepi).
Za določitev varnosti in učinkovitosti odmerjanja pri bolnikih s hudo okvaro ledvic ni zadostnih informacij (glej Klinična farmakologija in Previdnostni ukrepi).
Pri starejših bolnikih se lahko zaradi staranja zmanjša izločanje armodafinila in njegovih presnovkov. Zato je treba pri tej populaciji upoštevati uporabo nižjih odmerkov (glej Klinična farmakologija in Previdnostni ukrepi).
vrh
Kako dobava / skladiščenje in ravnanje
Nuvigil® (armodafinil) Tablete [C-IV]
50 mg: Vsaka okrogla tableta je bela do bela  na eni strani in "205" na drugi.
na eni strani in "205" na drugi.
NDC 63459-205-60 - Steklenice po 60
150 mg: Vsaka ovalna, bela do bela tableta je odtisnjena  na eni strani in "215" na drugi.
na eni strani in "215" na drugi.
NDC 63459-215-60 - Steklenice po 60
250 mg: Vsaka ovalna, bela do bela tableta je odtisnjena  na eni strani in "225" na drugi.
na eni strani in "225" na drugi.
NDC 63459-225-60 - Steklenice po 60
Shranjujte pri 20 ° - 25 ° C (68 ° - 77 ° F).
Izdelano za:
Cephalon, Inc.
Frazer, PA 19355
nazadnje posodobljeno 02/2010
Informacije o bolniku Nuvigil (v navadni angleščini)
Podrobne informacije na Znaki, simptomi, vzroki, zdravljenje motenj spanja
Informacije v tej monografiji ne zajemajo vseh možnih načinov uporabe, navodil, previdnostnih ukrepov, interakcij z zdravili ali škodljivih učinkov. Te informacije so posplošene in niso mišljene kot poseben zdravniški nasvet. Če imate vprašanja o zdravilih, ki jih jemljete ali bi želeli več informacij, se posvetujte s svojim zdravnikom, farmacevtom ali medicinsko sestro.
nazaj k:
~ vsi članki o motnjah spanja


