Actos za sladkorno bolezen tipa 2
Blagovna znamka: Actos
Splošno ime: Pioglitazon hidroklorid
Vsebina:
Opis
Farmakologija
Indikacije in uporaba
Kontraindikacije
Opozorila
Previdnostni ukrepi
Neželeni učinki
Predoziranje
Odmerjanje in uporaba
Kako dobavljeno
Actos, pioglitazon hcl, podatki o bolniku (v navadni angleščini)
OPOZORILO: KONGESTIVNA NAPAKA SRCA
- Tiazolidindioni, vključno z Actosom, pri nekaterih bolnikih povzročajo ali poslabšajo kongestivno srčno popuščanje (glejte OPOZORILA). Po uvedbi zdravila Actos in po zvišanju odmerka pazljivo opazujte bolnike glede znakov in simptomov srčnega popuščanja (vključno s prekomernim, hitrim pridobivanjem telesne mase, dispnejo in / ali edemom). Če se ti znaki in simptomi razvijejo, je treba srčno popuščanje obvladovati v skladu s trenutnimi standardi oskrbe. Poleg tega je treba razmisliti o ukinitvi ali zmanjšanju odmerka zdravila Actos.
- Actos ni priporočljiv pri bolnikih s simptomatskim srčnim popuščanjem. Uvajanje zdravila Actos pri bolnikih z ugotovljenim srčnim popuščanjem razreda III ali IV NYHA je kontraindicirano (glejte KONTRAINDIKACIJE in OPOZORILA).
Opis
Actos (pioglitazon hidroklorid) je peroralno antidiabetično sredstvo, ki deluje predvsem z zmanjšanjem odpornosti na inzulin. Zdravilo Actos se uporablja pri zdravljenju diabetesa mellitusa tipa 2 (znan tudi kot diabetes, ki ni odvisen od insulina, diabetes mellitus [NIDDM] ali sladkorna bolezen pri odraslih). Farmakološke študije kažejo, da Actos izboljša občutljivost na inzulin v mišičnem in maščobnem tkivu in zavira jetrno glukoneogenezo. Actos izboljšuje nadzor glikemije in hkrati znižuje raven insulina v obtoku.
Pioglitazon [(±) -5 - [[4- [2- (5-etil-2-piridinil) etoksi] fenil] metil] -2,4-] tiazolidindion monohidroklorid pripada drugačen kemični razred in ima drugačno farmakološko delovanje kot sulfonilsečnine, metformin ali Î--glukozidaza zaviralci. Molekula vsebuje en asimetričen ogljik, spojino pa sintetiziramo in uporabljamo kot racemsko zmes. Dva enantiomera pioglitazona se medsebojno pretvorita in vivo. V farmakoloških aktivnostih obeh enantiomerov niso bile ugotovljene razlike. Strukturna formula je prikazana:
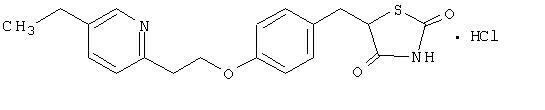
Pioglitazon hidroklorid je beli kristalni prah brez vonja, ki ima molekularno formulo C19H20N2O3S-HCl in molekulsko maso 392,90 daltona. Topen je v N, N-dimetilformamidu, rahlo topen v brezvodnem etanolu, zelo slabo topen v acetonu in acetonitrilu, praktično netopen v vodi in netopen v etru.
Zdravilo Actos je na voljo v obliki tablet za peroralno uporabo, ki vsebuje 15 mg, 30 mg ali 45 mg pioglitazona (kot baze), pripravljenega z naslednje pomožne snovi: lAktoza monohidrat NF, hidroksipropilceluloza NF, karboksimetilceluloza kalcij NF in magnezijev stearat NF.
vrh
Klinična farmakologija
Mehanizem delovanja
Actos je antidiabetično sredstvo tiazolidindion, ki je odvisno od prisotnosti inzulina za njegov mehanizem delovanja. Actos zmanjša odpornost na inzulin na obrobju in v jetrih, kar ima za posledico povečano odstranjevanje glukoze od insulina in zmanjšano jetrno glukozo. Za razliko od sulfonilsečnine pioglitazon ni insulinski sekretagog. Pioglitazon je močan agonist za peroksisom proliferator aktivirani receptor-gama (PPAR3). PPAR receptorje najdemo v tkivih, pomembnih za delovanje inzulina, kot so maščobno tkivo, skeletne mišice in jetra. Aktivacija nuklearnih receptorjev PPARγ modulira prepisovanje številnih genov, ki so odzivni na inzulin, ki sodelujejo pri nadzoru metabolizma glukoze in lipidov.
V živalskih modelih sladkorne bolezni pioglitazon zmanjšuje hiperglikemijo, hiperinzulinemijo in hipertrigliceridemijo, značilno za insulinsko odporna stanja, kot je diabetes tipa 2. Presnovne spremembe, ki jih povzroča pioglitazon, povzročajo povečano odzivnost tkiv, odvisnih od insulina, in jih opazimo v številnih živalskih modelih odpornosti na inzulin.
Ker pioglitazon povečuje učinke insulina v obtoku (z zmanjšanjem odpornosti na inzulin), v živalskih modelih, ki nimajo endogenega insulina, ne zniža glukoze v krvi.
Farmakokinetika in presnova zdravil
Serumske koncentracije celotnega pioglitazona (pioglitazon plus aktivni presnovki) ostanejo povišane 24 ur po odmerjanju enkrat na dan. Serumske koncentracije pioglitazona in skupnega pioglitazona v stanju dinamičnega ravnovesja so dosežene v 7 dneh. V stanju dinamičnega ravnovesja dva farmakološko aktivna presnovka pioglitazona, Metabolites III (M-III) in IV (M-IV), dosežeta serumske koncentracije, enake ali večje od pioglitazona. Tako pri zdravih prostovoljcih kot pri bolnikih s sladkorno boleznijo tipa 2 pioglitazon obsega približno 30% do 50% največje skupne serumske koncentracije pioglitazona in 20% do 25% celotne površine pod krivuljo koncentracije in časa v serumu (AUC).
Najvišja serumska koncentracija (Cmaks), AUC in najnižje koncentracije v serumu (Cmin) tako za pioglitazon kot celoten pioglitazon naraščata sorazmerno pri odmerkih 15 mg in 30 mg na dan. Za pioglitazon in skupni pioglitazon je odmerek 60 mg na dan nekoliko manjši od sorazmernega.
Absorpcija: Po peroralni uporabi je pioglitazon najprej meriti v serumu v 30 minutah, najvišje koncentracije pa opaziti v 2 urah. Hrana nekoliko odloži čas do največje koncentracije v serumu na 3 do 4 ure, vendar ne spremeni obsega absorpcije.
Porazdelitev: Povprečni navidezni volumen porazdelitve (Vd / F) pioglitazona po uporabi enega odmerka je 0,63 ± 0,41 (srednja vrednost ± SD) L / kg telesne mase.
Pioglitazon je v človeškem serumu v veliki meri vezan na beljakovine (> 99%), predvsem na serumski albumin. Pioglitazon se veže tudi na druge serumske beljakovine, vendar z nižjo afiniteto. Presnovki M-III in M-IV sta tudi močno vezani (> 98%) na serumski albumin.
Presnova: Pioglitazon se intenzivno presnavlja s hidroksilacijo in oksidacijo; presnovki se deloma pretvorijo tudi v glukuronidne ali sulfatne konjugate. Presnovki M-II in M-IV (hidroksi derivati pioglitazona) in M-III (keto derivat pioglitazona) so farmakološko aktivni na živalskih modelih sladkorne bolezni tipa 2. M-III in M-IV sta poleg pioglitazona glavni vrsti, povezani z zdravili, ki ju najdemo v človeškem serumu po večkratnem odmerjanju. V stanju dinamičnega ravnovesja je tako pri zdravih prostovoljcih kot pri bolnikih s sladkorno boleznijo tipa 2 pioglitazon obsega približno 30% do 50% skupnih najvišjih serumskih koncentracij in 20% do 25% skupni AUC.
Podatki in vitro kažejo, da je v presnovo pioglitazona vključenih več izoform CYP. Vključeni izoformi citokroma P450 sta CYP2C8 in v manjši meri CYP3A4 z dodatnimi prispevki različnih drugih izoform, vključno s pretežno zunajtrpno CYP1A1. In vivo so bile izvedene študije pioglitazona v kombinaciji z zaviralci P450 in substrati (glejte) Interakcije z zdravili). Urinski razmerji 6Ã-hidroksikortizola / kortizola, izmerjeni pri bolnikih, zdravljenih z Actosom, so pokazali, da pioglitazon ni močan induktor encimov CYP3A4.
Izločanje in izločanje: Po peroralni uporabi se približno 15% do 30% odmerka pioglitazona v urinu izloči. Ledvična eliminacija pioglitazona je zanemarljiva, zdravilo pa se izloča predvsem v obliki presnovkov in njihovih konjugatov. Domneva se, da se večina peroralnega odmerka izloči v žolč v nespremenjeni obliki ali v obliki presnovkov in se izloči v blatu.
Povprečni razpolovni čas pioglitazona v serumu in skupni pioglitazon se gibljeta od 3 do 7 ur in 16 do 24 ur. Pioglitazon ima očiten očistek, CL / F, izračunano na 5 do 7 L / uro.
Posebne populacije
Ledvična insuficienca: Razpolovni čas izločanja pioglitazona, M-III in M-IV v serumu ostane pri bolnikih z zmerno nespremenjeno. (očistek kreatinina 30 do 60 ml / min) do hude okvare ledvic (očistek kreatinina <30 ml / min) subjekti. Prilagajanje odmerka pri bolnikih z ledvično disfunkcijo ni priporočljivo (glejte ODDELEK IN UPORABA).
Jetrna insuficienca: V primerjavi z običajnimi kontrolami imajo osebe z okvarjenim delovanjem jeter (Child-Pugh razred B / C) približno 45-odstotno znižanje povprečnih najvišjih koncentracij pioglitazona in skupnega pioglitazona, brez spremembe povprečne AUC vrednote.
Terapije z actosom se ne sme začeti, če ima bolnik klinične dokaze o aktivni jetrni bolezni ali ravni transaminaze v serumu (ALT), ki presega 2,5-krat večjo zgornjo mejo normale (glejte VARNOSTNI UKREPI, Jetrni učinki).
Starejši: Pri zdravih starejših osebah največje serumske koncentracije pioglitazona in skupnega pioglitazona niso bistveno drugačne, vendar so vrednosti AUC nekoliko višje in končne razpolovne dobe nekoliko daljše kot pri mlajši subjekti. Te spremembe niso bile take velikosti, ki bi jih šteli za klinično pomembne.
Pediatrija: Farmakokinetični podatki pri otroški populaciji niso na voljo.
Spol: Srednja vrednost Cmaks in vrednosti AUC pri ženskah so se povečale za 20% do 60%. Kot monoterapija in v kombinaciji s sulfonilsečnino, metforminom ali insulinom je Actos izboljšal nadzor glikemije pri moških in ženskah. V kontroliranih kliničnih preskušanjih je hemoglobin A1c (HbA1c) padec izhodiščne vrednosti je bil na splošno večji pri ženskah kot pri moških (povprečna povprečna razlika HbA)1c 0.5%). Ker je za doseganje glikemične kontrole treba pri vsakem bolniku terapijo individualno prilagoditi, se odsvetuje prilagoditev odmerka na podlagi samega spola.
Etnična pripadnost: Farmakokinetični podatki med različnimi etničnimi skupinami niso na voljo.
Interakcije med drogami
Naslednja zdravila so preučevali pri zdravih prostovoljcih ob sočasni uporabi zdravila Actos 45 mg enkrat na dan. Spodaj so navedeni rezultati:
Peroralni kontraceptivi: Sočasna uporaba zdravila Actos (45 mg enkrat na dan) in peroralnega kontracepcijskega sredstva (1 mg noretindrona plus 0,035 mg etinilestradiola enkrat na dan) 21 dni, kar je povzročilo 11% in 11-14% znižanje AUC etil-estradiola (0-24h) in Cmaks oz. V AUC noretindrona (0-24h) in C ni bilo pomembnih spremembmaks. Zaradi velike variabilnosti farmakokinetike etinilestradiola klinični pomen te ugotovitve ni znan.
Feksofenadin HCl: Sočasna uporaba Actosa 7 dni s 60 mg feksofenadina, ki se daje oralno dvakrat na dan, ni imela pomembnega učinka na farmakokinetiko pioglitazona. Actos ni imel pomembnega vpliva na farmakokinetiko feksofenadina.
Glipizid: Sočasna uporaba Actosa in 5 mg glipizida, ki se dajeta peroralno enkrat na dan 7 dni, ni spremenila farmakokinetike glipizida v stanju dinamičnega ravnovesja.
Digoksin: Sočasna uporaba zdravila Actos z 0,25 mg digoksina, ki se daje oralno enkrat dnevno 7 dni, ni spremenila farmakokinetike digoksina v stanju dinamičnega ravnovesja.
Varfarin: Sočasna uporaba zdravila Actos 7 dni z varfarinom ni spremenila farmakokinetike varfarina v stanju dinamičnega ravnovesja. Actos nima klinično pomembnega učinka na protrombinski čas, kadar ga dajemo bolnikom, ki prejemajo kronično zdravljenje z varfarinom.
Metformin: Sočasna uporaba enega odmerka metformina (1000 mg) in Actosa po 7 dneh zdravila Actos ni spremenila farmakokinetike posameznega odmerka metformina.
Midazolam: Dajanje zdravila Actos 15 dni, ki mu je sledil enodomen odmerek 7 mg mg midazolam sirupa, je povzročilo 26-odstotno zmanjšanje midazolama Cmaks in AUC.
Ranitidin HCl: Sočasna uporaba zdravila Actos 7 dni z ranitidinom, ki se daje oralno dvakrat na dan bodisi 4 ali 7 dni, ni povzročila pomembnega učinka na farmakokinetiko pioglitazona. Actos ni pokazal pomembnega vpliva na farmakokinetiko ranitidina.
Nifedipin ER: Sočasna uporaba zdravila Actos 7 dni s 30 mg nifedipina ER peroralno enkrat na dan 4 dni moški in ženski prostovoljci so povzročili najmanj kvadratne povprečne vrednosti (90% CI) za nespremenjeni nifedipin 0,83 (0,73 - 0,95) za Cmaks in 0,88 (0,80 - 0,96) za AUC. Zaradi velike variabilnosti farmakokinetike nifedipina klinični pomen te ugotovitve ni znan.
Ketokonazol: Sočasna uporaba zdravila Actos 7 dni z dvakratnim ketokonazolom v odmerku 200 mg dnevno so imele najmanj kvadratne povprečne vrednosti (90% CI) za nespremenjeni pioglitazon 1,14 (1,06 - 1,23) za Cmaks, 1,34 (1,26 - 1,41) za AUC in 1,87 (1,71 - 2,04) za Cmin.
Atorvastatin kalcij: Sočasna uporaba zdravila Actos 7 dni z atorvastatinskim kalcijem (LIPITOR®) 80 mg Enkrat na dan je prišlo do najmanj kvadratnih povprečnih vrednosti (90% CI) za nespremenjeni pioglitazon 0,69 (0,57 - 0,85) za Cmaks0,76 (0,65 - 0,88) za AUC in 0,96 (0,87 - 1,05) za Cmin. Pri nespremenjenem atorvastatinu so bile najmanjše povprečne vrednosti (90% CI) 0,77 (0,66 - 0,90) za Cmaks, 0,86 (0,78 - 0,94) za AUC in 0,92 (0,82 - 1,02) za Cmin.
Teofilin: Sočasna uporaba zdravila Actos 7 dni s 400 mg teofilina dvakrat na dan ni povzročila sprememb farmakokinetike obeh zdravil.
Citokrom P450: Glej VARNOSTNI UKREPI
Gemfibrozil: Sočasno jemanje gemfibrozila (peroralno 600 mg dvakrat na dan), zaviralca CYP2C8, s pioglitazonom (30 mg peroralno) pri 10 zdravih prostovoljcih, predhodno zdravljenih 2 dni pred gemfibrozilom (peroralno 600 mg dvakrat na dan) je prišlo do izpostavljenosti pioglitazonu (AUC0-24) 226% izpostavljenosti pioglitazonu, če gemfibrozila ni bilo (glej VARNOSTNI UKREPI).
Rifampin: Sočasno jemanje rifampina (peroralno 600 mg enkrat na dan), induktorja CYP2C8 s pioglitazonom (30 mg peroralno) pri 10 zdravih prostovoljci, predhodno zdravljeni z rifampinom (peroralno 600 mg enkrat dnevno), so povzročili znižanje AUC pioglitazona za 54% (glejte VARNOSTNI UKREPI).
Farmakodinamika in klinični učinki
Klinične študije kažejo, da Actos izboljša inzulinsko občutljivost pri bolnikih, odpornih proti insulinu. Actos poveča celično odzivnost na inzulin, poveča odstranjevanje glukoze od insulina, izboljša občutljivost jeter na inzulin in izboljša disfunkcionalno homeostazo glukoze. Pri bolnikih s sladkorno boleznijo tipa 2 zmanjšana odpornost na inzulin, ki jo proizvaja Actos, povzroči nižje koncentracije glukoze v plazmi, nižje ravni plazme inzulina in nižjo HbA1c vrednote. Na podlagi rezultatov odprte razširitvene študije se zdi, da učinki Actosa na zniževanje glukoze vztrajajo vsaj eno leto. V kontroliranih kliničnih preskušanjih je imel Actos v kombinaciji s sulfonilsečnino, metforminom ali insulinom dodaten učinek na nadzor glikemije.
Bolniki z lipidnimi motnjami so bili vključeni v klinična preskušanja z zdravilom Actos. Na splošno so bolniki, zdravljeni z Actosom, imeli povprečno znižanje trigliceridov, povprečno povečanje holesterola HDL in neskladnih povprečnih sprememb LDL in skupnega holesterola.
V 26-tedenski, s placebom nadzorovani študiji glede na odmerek, so se povprečne ravni trigliceridov zmanjšale v skupinah odmerkov 15 mg, 30 mg in 45 mg Actos v primerjavi s povprečnim povečanjem skupine, ki je prejemala placebo. Povprečne vrednosti HDL so se v večji meri zvišale pri bolnikih, ki se zdravijo z Actosom, kot pri bolnikih, ki so prejemali placebo. Pri bolnikih, zdravljenih z Actosom, v primerjavi s placebom ni bilo konstantnih razlik (LDL) in skupnega holesterola (tabela 1)
Tabela 1 Lipidi v 26-tedenski raziskavi odmerjanja monoboterapije s placebom
| Placebo | Actos 15 mg Enkrat Vsakodnevno |
Actos 30 mg Enkrat Vsakodnevno |
Actos 45 mg Enkrat Vsakodnevno |
|
| Trigliceridi (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Izhodišče (povprečje) | 262.8 | 283.8 | 261.1 | 259.7 |
| Odstotek spremembe od osnovne (povprečna) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL holesterol (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Izhodišče (povprečje) | 41.7 | 40.4 | 40.8 | 40.7 |
| Odstotek spremembe od osnovne (povprečna) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL holesterol (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Izhodišče (povprečje) | 138.8 | 131.9 | 135.6 | 126.8 |
| Odstotek spremembe od osnovne (povprečna) | 4.8% | 7.2% | 5.2% | 6.0% |
| Skupni holesterol (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Izhodišče (povprečje) | 224.6 | 220.0 | 222.7 | 213.7 |
| Odstotek spremembe od osnovne (povprečna) | 4.4% | 4.6% | 3.3% | 6.4% |
V dveh drugih študijah monoterapije (24 tednov in 16 tednov) in v študijah kombinirane terapije s sulfonilsečnino (24 tednov in 16 tednov) in metformin (24 tednov in 16 tednov), so bili rezultati na splošno skladni s podatki nad. V preskušanjih, nadzorovanih s placebom, so se povprečne spremembe, korigirane s placebom, glede na izhodišče znižale za 5% na 26% za trigliceride in povečale za 6% do 13% za HDL pri bolnikih, zdravljenih z Actos. Podoben vzorec rezultatov so opazili v 24-tedenskih študijah kombinirane terapije Actos s sulfonilsečnino ali metforminom.
V študiji kombinirane terapije z insulinom (16 tednov) se je zmanjšala tudi povprečno odstotna sprememba placeba, korigirana glede na izhodiščne vrednosti trigliceridov pri bolnikih, zdravljenih z Actosom. Pri skupini z odmerkom 15 mg so odkrili placebo-korigirano povprečno spremembo holesterola LDL v primerjavi z izhodiščno vrednostjo 7%. Opaženi so bili podobni rezultati kot pri zgoraj omenjenih za HDL in skupni holesterol. Podoben vzorec rezultatov je bil opažen v 24-tedenski študiji kombinirane terapije z zdravilom Actos z insulinom.
Klinične študije
Monoterapija
V ZDA so izvedli tri randomizirana, dvojno slepa, s placebom nadzorovana preskušanja s trajanjem od 16 do 26 tednov za oceno uporabe Actosa kot monoterapije pri bolnikih s sladkorno boleznijo tipa 2. V teh študijah so pri 865 bolnikih pregledali Actos v odmerkih do 45 mg ali placebo enkrat na dan.
V 26-tedenski študiji, ki je odvisna od odmerka, so 408 bolnikov s sladkorno boleznijo tipa 2 naključno prejeli 7,5 mg, 15 mg, 30 mg ali 45 mg zdravila Actos ali placebo enkrat na dan. Terapijo s katerim koli predhodnim antidiabetikom so prekinili 8 tednov pred dvojno slepim obdobjem. Zdravljenje s 15 mg, 30 mg in 45 mg zdravila Actos je povzročilo statistično pomembne izboljšave HbA1c in glukoze v plazmi na tešče (FPG) na koncu v primerjavi s placebom (slika 1, preglednica 2).
Slika 1 prikazuje časovni potek sprememb FPG in HbA1c za celotno populacijo študije v tej 26-tedenski študiji.
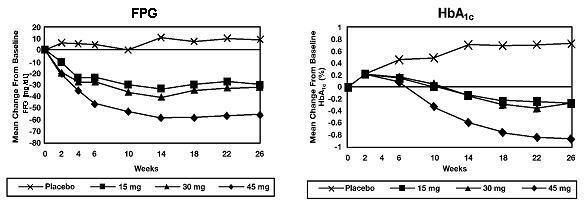
Tabela 2 prikazuje HbA1c in vrednosti FPG za celotno populacijo študije.
Tabela 2 Glikemični parametri v 26-tedenski študiji razvrščanja odmerkov s placebom
| Placebo | Actos 15 mg Enkrat Vsakodnevno |
Actos 30 mg Enkrat Vsakodnevno |
Actos 45 mg Enkrat Vsakodnevno |
|
| SKUPAJ PREBIVALSTVO | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Izhodišče (povprečje) | 10.4 | 10.2 | 10.2 | 10.3 |
| Sprememba od osnovne (prilagojena srednja vrednost)+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Razlika od placeba (prilagojena srednja vrednost)+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Izhodišče (povprečje) | 268 | 267 | 269 | 276 |
| Sprememba od osnovne (prilagojena srednja vrednost)+) | 9 | -30 | -32 | -56 |
| Razlika od placeba (prilagojena srednja vrednost)+) | -39* | -41* | -65* | |
|
+ Prilagojeno za osnovno linijo, združeni center in združeni center z interakcijo zdravljenja * p â ‰ ¤ 0,050 vs. placebo |
V populacijo študije so bili vključeni bolniki, ki prej niso bili zdravljeni z antidiabetiki (naa; 31%) in bolnikov, ki so ob vpisu v študijo (predhodno zdravljeni) prejemali antidiabetična zdravila; 69%). Podatki za podskupine nav in predhodno zdravljenih bolnikov so prikazani v tabeli 3. Vsi bolniki so pred zdravljenjem z dvojno slepo vstopili v 8-tedensko obdobje umivanja / iztekanja. To obdobje uvajanja je bilo povezano z majhnimi spremembami HbA1c in vrednosti FPG od presejanja do izhodiščne vrednosti za bolnike; vendar je za prej zdravljeno skupino izpiranje iz prejšnjih antidiabetikov povzročilo poslabšanje nadzora glikemije in povečanje HbA1c in FPG. Čeprav se je pri večini bolnikov v prej zdravljeni skupini znižal HbA v primerjavi z izhodiščem1c in FPG z Actosom, v mnogih primerih se vrednosti do konca študije niso vrnile na presejalne ravni. Zasnova študije ni omogočala ocene bolnikov, ki so na drugo zdravilo Actos prešli z drugega antidiabetičnega zdravila.
Tabela 3 Glikemični parametri v 26-tedenski študiji razvrščanja odmerkov s placebom
| Placebo | Actos 15 mg Enkrat Vsakodnevno |
Actos 30 mg Enkrat Vsakodnevno |
Actos 45 mg Enkrat Vsakodnevno |
|
| Naïve to terapijo HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Presejanje (srednje) | 9.3 | 10.0 | 9.5 | 9.8 |
| Izhodišče (povprečje) | 9.0 | 9.9 | 9.3 | 10.0 |
| Sprememba od osnovne (prilagojena srednja vrednost *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Razlika od placeba (prilagojeno povprečje *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Presejanje (srednje) | 223 | 245 | 239 | 239 |
| Izhodišče (povprečje) | 229 | 251 | 225 | 235 |
| Sprememba od osnovne (prilagojena srednja vrednost *) | 16 | -37 | -41 | -64 |
| Razlika od placeba (prilagojeno povprečje *) | -52 | -56 | -80 | |
| Prej obdelano HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Presejanje (srednje) | 9.3 | 9.0 | 9.1 | 9.0 |
| Izhodišče (povprečje) | 10.9 | 10.4 | 10.4 | 10.6 |
| Sprememba od osnovne (prilagojena srednja vrednost *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Razlika od placeba (prilagojeno povprečje *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Presejanje (srednje) | 222 | 209 | 230 | 215 |
| Izhodišče (povprečje) | 285 | 275 | 286 | 292 |
| Sprememba od osnovne (prilagojena srednja vrednost *) | 4 | -32 | -27 | -55 |
| Razlika od placeba (prilagojeno povprečje *) | -36 | -31 | -59 | |
| * Prilagojeno za osnovno linijo in združeni center |
V 24-tedenski, s placebom nadzorovani študiji, je bilo 260 bolnikov s sladkorno boleznijo tipa 2 naključno razvrščenih v eno od dveh skupin za zdravljenje s prisilno titracijo Actos ali s posmehljivo titracijo s placebom. Terapijo s katerim koli predhodnim antidiabetikom so prekinili 6 tednov pred dvojno slepim obdobjem. V eni skupini zdravljenja z zdravilom Actos so bolniki prejemali začetni odmerek 7,5 mg enkrat na dan. Po štirih tednih so odmerek povečali na 15 mg enkrat na dan, po nadaljnjih štirih tednih pa so odmerek povečali na 30 mg enkrat na dan za preostanek študije (16 tednov). V drugi skupini zdravljenja z zdravilom Actos so bolniki prejemali začetni odmerek 15 mg enkrat na dan, titrirali pa so ga na 30 mg enkrat na dan in 45 mg enkrat na dan na podoben način. Zdravljenje z zdravilom Actos, kot je opisano, je povzročilo statistično pomembne izboljšave HbA1c in FPG v končni točki v primerjavi s placebom (preglednica 4).
Tabela 4 Glikemični parametri v 24-tedenski študiji prisilne titracije s placebom
| Placebo | Actos 30 mg+ Enkrat na dan |
Actos 45 mg+ Enkrat na dan |
|
| Skupno prebivalstvo HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Izhodišče (povprečje) | 10.8 | 10.3 | 10.8 |
| Sprememba od osnovne (prilagojena srednja vrednost)++) | 0.9 | -0.6 | -0.6 |
| Razlika od placeba (prilagojena srednja vrednost)++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Izhodišče (povprečje) | 279 | 268 | 281 |
| Sprememba od osnovne (prilagojena srednja vrednost)++) | 18 | -44 | -50 |
| Razlika od placeba (prilagojena srednja vrednost)++) | -62* | -68* | |
|
+ Končni odmerek v prisilni titraciji ++ Prilagojeno za osnovno linijo, združeni center in združeni center z interakcijo zdravljenja * p â ‰ ¤ 0,050 vs. placebo |
Pri bolnikih, ki prej niso bili zdravljeni z antidiabetiki (24%), so bile povprečne vrednosti pri presejanju 10,1% za HbA1c in 238 mg / dL za FPG. Izhodiščno pomeni HbA1c znašala 10,2%, povprečna vrednost FPG pa je bila 243 mg / dL. V primerjavi s placebom je zdravljenje z Actosom, titriranim do končnega odmerka 30 mg in 45 mg, povzročilo znižanje povprečne vrednosti HbA1c 2,3% in 2,6%, povprečni FPG pa 63 mg / dL oziroma 95 mg / dL. Pri bolnikih, ki so se že zdravili z antidiabetiki (76%), so to zdravilo ob pregledu prekinili. Povprečne vrednosti pri presejanju so bile 9,4% za HbA1c in 216 mg / dL za FPG. Izhodiščno pomeni HbA1c znašala 10,7%, povprečna vrednost FPG pa je bila 290 mg / dL. V primerjavi s placebom je zdravljenje z Actosom, titriranim do končnega odmerka 30 mg in 45 mg, povzročilo znižanje povprečne vrednosti HbA1c od 1,3% in 1,4%, povprečna koncentracija FPG pa 55 mg / dL oziroma 60 mg / dL. Pri mnogih predhodno zdravljenih bolnikih je HbA1c in FPG se do konca študije ni vrnil na presejalne ravni.
V 16-tedenski študiji je bilo 197 bolnikov s sladkorno boleznijo tipa 2 naključno na zdravljenje s 30 mg zdravila Actos ali placeba enkrat na dan. Terapijo s katerim koli predhodnim antidiabetikom so prekinili 6 tednov pred dvojno slepim obdobjem. Zdravljenje s 30 mg zdravila Actos je povzročilo statistično pomembne izboljšave HbA1c in FPG v končni točki v primerjavi s placebom (tabela 5).
Tabela 5 Glikemični parametri v 16-tedenski študiji s placebom
| Placebo | Actos 30 mg Enkrat na dan |
|
| Skupno prebivalstvo HbA1c (%) |
N = 93 | N = 100 |
| Izhodišče (povprečje) | 10.3 | 10.5 |
| Sprememba od osnovne (prilagojena srednja vrednost)+) | 0.8 | -0.6 |
| Razlika od placeba (prilagojena srednja vrednost)+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Izhodišče (povprečje) | 270 | 273 |
| Sprememba od osnovne (prilagojena srednja vrednost)+) | 8 | -50 |
| Razlika od placeba (prilagojena srednja vrednost)+) | -58* | |
|
+ Prilagojeno za osnovno linijo, združeni center in združeni center z interakcijo zdravljenja * p â ‰ ¤ 0,050 vs. placebo |
Za bolnike, ki prej niso bili zdravljeni z antidiabetiki (40%), so bile povprečne vrednosti pri presejanju 10,3% za HbA1c in 240 mg / dL za FPG. Izhodiščno pomeni HbA1c znašala 10,4%, povprečna vrednost FPG pa je bila 254 mg / dL. V primerjavi s placebom je zdravljenje z zdravilom Actos 30 mg povzročilo znižanje povprečne vrednosti HbA1c od 1,0%, povprečni FPG pa 62 mg / dL. Pri bolnikih, ki so bili pred tem zdravljeni z antidiabetiki (60%), so to zdravilo ob pregledu prekinili. Povprečne vrednosti pri presejanju so bile 9,4% za HbA1c in 216 mg / dL za FPG. Izhodiščno pomeni HbA1c znašala 10,6%, povprečna vrednost FPG pa je bila 287 mg / dL. V primerjavi s placebom je zdravljenje z zdravilom Actos 30 mg povzročilo znižanje povprečne vrednosti HbA1c od 1,3%, povprečni FPG pa 46 mg / dL. Pri mnogih predhodno zdravljenih bolnikih je HbA1c in FPG se do konca študije ni vrnil na presejalne ravni.
Kombinirana terapija
Tri 16-tedenske, randomizirane, dvojno slepe, s placebom nadzorovane klinične študije in tri 24-tedenske, randomizirane, dvojno slepe, z nadzorom odmerka so bile izvedene klinične študije za oceno učinkov Actos na nadzor glikemije pri bolnikih s sladkorno boleznijo tipa 2, ki so bili neustrezni nadzorovano (HbA)1c ‰ ¥ 8%) kljub trenutni terapiji s sulfonilsečnino, metforminom ali insulinom. Prejšnje zdravljenje sladkorne bolezni je bilo morda monoterapija ali kombinirano zdravljenje.
Študije sulfonilsečnine Actos Plus
Opravljeni sta bili dve klinični študiji z zdravilom Actos v kombinaciji s sulfonilsečnino. Obe študiji sta vključevali bolnike s sladkorno boleznijo tipa 2 na sulfonilsečnini, bodisi samostojno bodisi v kombinaciji z drugim antidiabetikom. Vsa druga protidiabetična zdravila so bila umaknjena pred začetkom zdravljenja v študiji. V prvi študiji je bilo 560 bolnikov randomiziranih, da so poleg sedanjega režima sulfonilsečnine prejemali 15 mg ali 30 mg zdravila Actos ali placeba enkrat na dan 16 tednov. V primerjavi s placebom v 16. tednu je dodatek Actosa k sulfonilsečnini znatno znižal povprečni HbA1c za 0,9% in 1,3%, povprečni FPG pa za 39 mg / dL in 58 mg / dL za odmerke 15 mg in 30 mg.
V drugi študiji je bilo 702 bolnikov randomiziranih, da so prejemali 30 mg ali 45 mg zdravila Actos enkrat na dan 24 tednov poleg trenutnega režima sulfonilsečnine. Povprečna znižanja glede na izhodišče v 24. tednu v HbA1c znašala 1,55% in 1,67% za odmerke 30 mg in 45 mg. Srednja zmanjšanja izhodiščne vrednosti FPG so znašala 51,5 mg / dL in 56,1 mg / dL.
Terapevtski učinek zdravila Actos v kombinaciji s sulfonilsečnino je bil opažen pri bolnikih, ne glede na to, ali so bolniki prejemali nizke, srednje ali visoke odmerke sulfonilsečnine.
Študije metformina Actos Plus
Opravljeni sta bili dve klinični študiji z zdravilom Actos v kombinaciji z metforminom. Obe študiji sta vključevali bolnike s sladkorno boleznijo tipa 2 na metformin, bodisi samostojno bodisi v kombinaciji z drugim antidiabetikom. Vsa druga protidiabetična zdravila so bila umaknjena pred začetkom zdravljenja v študiji. V prvi študiji je bilo 328 bolnikov naključno prejetih 30 mg zdravila Actos ali placeba enkrat na dan 16 tednov poleg njihovega trenutnega režima metformina. V primerjavi s placebom v 16. tednu je dodatek Actosa metforminu znatno znižal povprečni HbA1c za 0,8%, povprečni FPG pa zmanjšal za 38 mg / dL.
V drugi študiji so 827 bolnikov naključno prejeli 30 mg ali 45 mg zdravila Actos enkrat na dan 24 tednov poleg njihovega trenutnega režima metformina. Povprečna znižanja glede na izhodišče v 24. tednu v HbA1c znašala 0,80% in 1,01% za odmerke 30 mg in 45 mg. Srednja zmanjšanja izhodiščne vrednosti FPG so bila 38,2 mg / dL in 50,7 mg / dL.
Pri bolnikih so opazili terapevtski učinek zdravila Actos v kombinaciji z metforminom, ne glede na to, ali so bolniki prejemali nižje ali večje odmerke metformina.
Študije insulina Actos Plus
Opravljeni sta bili dve klinični študiji z zdravilom Actos v kombinaciji z insulinom. Obe študiji sta vključevali bolnike s sladkorno boleznijo tipa 2 na inzulin, bodisi samostojno bodisi v kombinaciji z drugim antidiabetikom. Vsa druga protidiabetična zdravila so bila umaknjena pred začetkom zdravljenja v študiji. V prvi študiji je bilo 566 bolnikov, ki so prejemali mediano 60,5 enot insulina na dan, randomizirano na 16 tednov poleg insulina prejmejo 15 mg ali 30 mg zdravila Actos ali placebo enkrat na dan režim. V primerjavi s placebom v 16. tednu je dodatek Actosa inzulinu znatno zmanjšal HbA1c za 0,7% in 1,0% in FPG za 35 mg / dL in 49 mg / dL za odmerek 15 mg in 30 mg.
V drugi študiji je 690 bolnikov, ki so prejemali mediano 60,0 enot insulina na dan, prejemalo bodisi 30 mg bodisi 45 mg zdravila Actos enkrat na dan 24 tednov poleg trenutnega režima insulina. Povprečna znižanja glede na izhodišče v 24. tednu v HbA1c znašala 1,17% in 1,46% za odmerke 30 mg in 45 mg. Srednja zmanjšanja izhodiščne vrednosti FPG so bila 31,9 mg / dL in 45,8 mg / dL. Izboljšano kontrolo glikemije je spremljalo povprečno zmanjšanje potrebnih odmerkov za odmerek 6,0% in odmerka 9,4% na dan za odmerek 30 mg in 45 mg.
Pri bolnikih so opazili terapevtski učinek zdravila Actos v kombinaciji z insulinom, ne glede na to, ali so bolniki prejemali nižje ali večje odmerke insulina.
vrh
Indikacije in uporaba
Actos je indiciran kot dodatek k prehrani in telesni vadbi za izboljšanje nadzora glikemije pri odraslih z diabetesom mellitusom tipa 2.
vrh
Kontraindikacije
Začetek zdravljenja z Actos pri bolnikih s sedežem New York Heart Association (NYHA) srčnega popuščanja razreda III ali IV je kontraindiciran (glejte OKVIRNO OPOZORILO).
Zdravilo Actos je kontraindicirano pri bolnikih z znano preobčutljivostjo za ta izdelek ali katero koli njegovo sestavino.
vrh
Opozorila
Srčna okvara in drugi srčni učinki
Actos, tako kot drugi tiazolidindioni, lahko povzroči zastajanje tekočine, če ga uporabljamo samo ali v kombinaciji z drugimi antidiabetiki, vključno z insulinom. Zadrževanje tekočine lahko povzroči ali poslabša srčno popuščanje. Bolnike je treba opazovati zaradi znakov in simptomov srčnega popuščanja. Če se ti znaki in simptomi razvijejo, je treba srčno popuščanje obvladovati v skladu s trenutnimi standardi oskrbe. Poleg tega je treba razmisliti o ukinitvi ali zmanjšanju odmerka zdravila Actos (glejte) OKVIRNO OPOZORILO). Bolnikov s srčnim stanjem razreda III in IV NYHA med kliničnimi preskušanji pred odobritvijo niso preučevali, zato Actos pri teh bolnikih ni priporočljiv (glejte OKVIRNO OPOZORILO in KONTRAINDIKACIJE).
V enem 16-tedenskem ameriškem dvojno slepem s placebom nadzorovanem kliničnem preskušanju, ki je vključevalo 566 bolnikov s tipom 2 diabetes, Actos v odmerkih 15 mg in 30 mg v kombinaciji z insulinom so primerjali z zdravljenjem z insulinom sam. V to preskušanje so bili vključeni pacienti z dolgotrajno sladkorno boleznijo in visoko razširjenostjo obstoječih zdravstvenih stanj, kot sledi: arterijska hipertenzija (57,2%), periferna nevropatija (22,6%), koronarna bolezen srca (19,6%), retinopatija (13,1%), miokard infarkt (8,8%), vaskularna bolezen (6,4%), angina pektoris (4,4%), možganska kap in / ali prehodni ishemični napad (4,1%) in kongestivni srčno popuščanje (2,3%).
V tej študiji sta dva od 191 bolnikov, ki so prejemali 15 mg Actos plus inzulin (1,1%), in dva od 188 bolnikov, ki so prejemala 30 mg Actos plus inzulin (1,1%) je razvil kongestivno srčno popuščanje v primerjavi z nobenim od 187 bolnikov, ki so prejemali samo zdravljenje z insulinom. Vsi štirje od teh bolnikov so imeli v preteklosti zgodovino srčno-žilnih stanj, vključno s koronarno arterijsko boleznijo, predhodnimi postopki CABG in miokardnim infarktom. V 24-tedenski študiji, nadzorovani z odmerkom, v kateri so zdravilo Actos dajali sočasno z insulinom, je 0,3% bolnikov (1/345) na 30 mg in 0,9% (3/345) bolnikov na 45 mg poročalo, da je CHF resen neželen dogodek .
Analiza podatkov iz teh študij ni odkrila posebnih dejavnikov, ki napovedujejo večje tveganje za kongestivno srčno popuščanje na kombiniranem zdravljenju z insulinom.
Pri sladkorni bolezni tipa 2 in kongestivnem srčnem popuščanju (sistolična disfunkcija)
Izvedena je bila 24-tedenska študija varnosti zdravila po trženju za primerjavo Actos (n = 262) z gliburida (n = 256) pri nenadzorovanih bolnikih s sladkorno boleznijo (povprečna HbA1c 8,8% v izhodišču) z srčnim popuščanjem razredov NYHA II in III in izmetnim deležem manj kot 40% (povprečna vrednost 30% EF v izhodišču). Med študijo so pri 9,9% poročali o hospitalizaciji za čezmerno srčno popuščanje čez noč bolnikov na Actosu v primerjavi s 4,7% bolnikov, ki so uživali gliburid, z razliko v zdravljenju od 6 tednov. Ta neželeni učinek, povezan z zdravilom Actos, je bil bolj izrazit pri bolnikih, ki so v začetku uporabljali inzulin, in pri bolnikih, starejših od 64 let. Med skupinami zdravljenja niso opazili razlike v kardiovaskularni umrljivosti.
Actos je treba začeti z najnižjim odobrenim odmerkom, če je predpisan bolnikom s sladkorno boleznijo tipa 2 in sistoličnim srčnim popuščanjem (razred NYHA II). Če je potrebno nadaljnje povečevanje odmerka, je treba odmerek postopoma povečevati šele po več mesecev zdravljenja s skrbnim spremljanjem povečanja telesne teže, edema ali znakov in simptomov CHF poslabšanje.
Možno klinično preskušanje pioglitazona pri makrovaskularnih dogodkih (proaktivno)
Pri zdravilu PROactive so 5238 bolnikov s sladkorno boleznijo tipa 2 in predhodno makrovaskularno boleznijo v preteklosti zdravili z Actosom (n = 2605), s titriranjem do 45 mg enkrat na dan ali s placebom (n = 2633) (glejte NEŽELENI REAKCI). Odstotek bolnikov, pri katerih je prišlo do resnega srčnega popuščanja, je bil višji pri bolnikih, zdravljenih z Actosom (5,7%, n = 149), kot pri bolnikih, zdravljenih s placebom (4,1%, n = 108). Incidenca smrti po poročilu o resnem srčnem popuščanju je bila 1,5% (n = 40) pri bolnikih, zdravljenih z zdravilom Actos, in 1,4% (n = 37) pri bolnikih, ki so prejemali placebo. Pri bolnikih, ki so se v začetku zdravili z insulinsko shemo, je bila incidenca resnega srčnega popuščanja 6,3% (n = 54/864) z zdravilom Actos in 5,2% (n = 47/896) s placebom. Pri tistih bolnikih, ki so se v začetku zdravili s shemo, ki vsebuje sulfonilureo, je bila incidenca resnega srčnega popuščanja 5,8% (n = 94/1624) z zdravilom Actos in 4,4% (n = 71/1626) s placebom.
vrh
Previdnostni ukrepi
Splošno
Actos ima svoj antihiperglikemični učinek le v prisotnosti insulina. Zato zdravila Actos ne smemo uporabljati pri bolnikih s sladkorno boleznijo tipa 1 ali za zdravljenje diabetične ketoacidoze.
Hipoglikemija: Bolniki, ki prejemajo Actos v kombinaciji z insulinom ali peroralnimi hipoglikemičnimi zdravili, lahko tvegajo hipoglikemijo, zato bo morda treba zmanjšati odmerek sočasnega zdravila.
Srčno-žilne: V ameriških, s placebom nadzorovanih kliničnih preskušanjih, ki so izključile bolnike s srčnim stanjem razreda New York Heart Association (NYHA) razreda III in IV, je pojavnost resnih srčnih neželenih dogodkov, povezanih s povečanjem volumna, pri bolnikih, ki so se zdravili z Actosom kot monoterapija ali v kombinaciji s sulfonilsečnino ali metforminom, se ni povečalo vs. bolnike, ki zdravijo s placebom. V študijah kombiniranega inzulina je manjše število bolnikov, ki so že bili v preteklosti srčna bolezen se je pri zdravljenju z zdravilom Actos v kombinaciji z insulinom razvila kongestivno srčno popuščanje (glej OPOZORILA). V teh kliničnih preskušanjih Actos niso preučevali bolnikov s srčnim stanjem razreda NYHA III in IV. Zdravilo Actos ni indicirano pri bolnikih s srčnim stanjem razreda III ali IV NYHA.
V izkušnjah s trženjem z zdravilom Actos so poročali o primerih kongestivnega srčnega popuščanja pri bolnikih z in brez prej znanih srčnih bolezni.
Edem: Pri bolnikih z edemom je treba zdravilo Actos uporabljati previdno. V vseh ameriških kliničnih preskušanjih so poročali o edemih pri bolnikih, ki so se zdravili z Actosom, kot pri bolnikih, ki so prejemali placebo, in zdi se, da so odvisni od odmerka (glejte NEŽELENI REAKCI). V izkušnjah po trženju so prejeli poročila o uvedbi ali poslabšanju edema. Ker tiazolidindioni, vključno z Actosom, lahko povzročijo zastajanje tekočine, kar lahko poslabša ali vodi do kongestivnega srčnega popuščanja, je treba zdravilo Actos uporabljati previdno pri bolnikih, pri katerih obstaja tveganje za srčno popuščanje. Bolnike je treba spremljati glede znakov in simptomov srčnega popuščanja (glej OKVIRNO OPOZORILO, OPOZORILA, in VARNOSTNI UKREPI).
Povečanje telesne mase: Povečanje telesne mase je povezano z odmerkom Actos in v kombinaciji z drugimi hipoglikemičnimi zdravili (tabela 6). Mehanizem povečevanja telesne mase je nejasen, vendar verjetno vključuje kombinacijo zadrževanja tekočine in nabiranja maščob.
Tabela 6 Spremembe teže (kg) glede na osnovno linijo med dvojno slepimi kliničnimi preskušanji z Actosom
| Nadzorna skupina (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediana (25th/75th v odstotkih) |
Mediana (25th/75th v odstotkih) |
Mediana (25th/75th v odstotkih) |
Mediana (25th/75th v odstotkih) |
||
| Monoterapija | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinirana terapija | Sulfonilurea | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformin | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Inzulin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Opomba: Preskusno trajanje od 16 do 26 tednov |
Ovulacija: Terapija z Actosom, tako kot drugimi tiazolidindioni, lahko pri nekaterih ženskah pred menopavzo anovulacijo povzroči ovulacijo. Posledično je pri teh bolnicah med jemanjem zdravila Acto morda večje tveganje za nosečnost. Zato je treba priporočiti ustrezno kontracepcijo pri ženskah pred menopavzo. V kliničnih študijah tega možnega učinka niso raziskali, zato pogostnost tega pojava ni znana.
Hematološki: Actos lahko povzroči znižanje hemoglobina in hematokrita. V vseh kliničnih študijah so se povprečne vrednosti hemoglobina znižale za 2% do 4% pri bolnikih, zdravljenih z Actosom. Te spremembe so se v prvi vrsti pojavile v prvih 4 do 12 tednih zdravljenja in so ostale relativno konstantne. Te spremembe so lahko povezane s povečanim volumnom plazme in so le redko povezane s pomembnimi hematološkimi kliničnimi učinki (glejte NEŽELENI REAKCI, Laboratorijske nepravilnosti).
Jetrni učinki: V kliničnih študijah pred odobritvijo po vsem svetu je bilo več kot 4500 oseb zdravljenih z zdravilom Actos. V ameriških kliničnih študijah je več kot 4700 bolnikov s sladkorno boleznijo tipa 2 prejelo zdravilo Actos. V kliničnih študijah ni bilo dokazov o povzročeni z zdravili hepatotoksičnosti ali zvišanju ravni ALT.
Med kliničnimi preskušanji pred odobritvijo s placebom v ZDA je bilo skupno 4 od 1526 (0,26%) bolnikov zdravljeni z Actosom in 2 od 793 (0,25%) bolnikov, ki so prejemali placebo, je imela vrednosti ALT ‰ times 3-kratno zgornjo mejo normalno. Zvišane vrednosti ALT pri bolnikih, zdravljenih z Actosom, so bile povratne in niso bile jasno povezane s terapijo z Actosom.
V izkušnjah z zdravilom Actos, ki so bile pred trženjem, so prejeli poročila o zvišanju hepatitisa in zvišanju jetrnih encimov do 3 ali večkrat od zgornje meje normale. Zelo redko so ta poročila vključevala odpoved jeter s smrtnim izidom in brez njega, čeprav vzročnost ni bila ugotovljena.
Do pričakovanja razpoložljivosti rezultatov dodatnih velikih, dolgoročno nadzorovanih kliničnih preskušanj in dodatnih Po podatkih o varnosti po trženju je priporočljivo, da bolniki, ki se zdravijo z Actosom, redno spremljajo jetra encimi.
Pred začetkom zdravljenja z zdravilom je treba oceniti ravni ALT (alanin aminotransferaze) v serumu Actos pri vseh bolnikih in občasno po klinični presoji zdravstvene oskrbe profesionalni. Jetrne preiskave je treba dobiti tudi pri bolnikih, če se pojavijo simptomi, ki kažejo na jetrno disfunkcijo, na primer slabost, bruhanje, bolečine v trebuhu, utrujenost, anoreksija ali temen urin. Odločitev, ali bo bolnika nadaljeval na terapiji z zdravilom Actos, mora temeljiti na klinični presoji do laboratorijskih presoj. Če opazimo zlatenico, je treba zdravljenje z zdravili prekiniti.
Terapije z zdravilom Actos se ne sme začeti, če ima bolnik klinične dokaze o aktivni jetrni bolezni ali če je ALT 2,5-krat večja od zgornje meje normale. Bolniki z blago povišanimi jetrnimi encimi (raven ALT pri 1 do 2,5-krat večji od zgornje meje normale) pri Za določitev vzroka jetrnih encimov je treba oceniti izhodišče ali kadar koli med zdravljenjem z zdravilom Actos nadmorska višina. Začeti ali nadaljevati zdravljenje z zdravilom Actos pri bolnikih z blago povišanimi jetrnimi encimi previdno in vključite ustrezno klinično spremljanje, ki lahko vključuje pogostejše jetrne encime spremljanje. Če so ravni transaminaze v serumu zvišane (ALT> 2,5-krat večja od zgornje meje normale), jetra funkcionalne teste je treba ocenjevati pogosteje, dokler se ravni ne vrnejo v normalno stanje ali predobdelave vrednote. Če vrednosti ALT presežejo 3-krat večjo zgornjo mejo normale, je treba preskus čim prej ponoviti. Če ravni ALT ostanejo> 3-krat večje od zgornje meje normalne vrednosti ali če je bolnik zlatenica, je treba zdravljenje z Actosom prekiniti.
Makularni edem: Pri izkušenjih v obdobju trženja pri bolnikih s sladkorno boleznijo, ki so jemali pioglitazon ali drug tiazolidindion, so poročali o makularnem edemu. Nekateri bolniki so imeli zamegljen vid ali zmanjšano ostrino vida, nekateri bolniki pa so bili diagnosticirani pri rutinskem oftalmološkem pregledu. Nekateri bolniki so imeli ob pojavu makularnega edema periferni edem. Nekateri bolniki so izboljšali makularni edem po ukinitvi tiazolidindiona. Ni znano, ali je med pioglitazonom in makularnim edemom vzročna zveza ali ne. Bolniki s sladkorno boleznijo morajo imeti redne preglede oči pri oftalmologu po standardih oskrbe Ameriškega diabetičnega združenja. Poleg tega je treba vsakega sladkornega bolnika, ki poroča o kakršnem koli vidnem simptomu, nemudoma napotiti k oftalmologu, ne glede na bolnikova osnovna zdravila ali druge fizične ugotovitve (glejte NEŽELENI REAKCI).
Zlomi: V randomiziranem preskušanju (PROactive) pri bolnikih s sladkorno boleznijo tipa 2 (povprečno trajanje sladkorna bolezen 9,5 leta), pri bolnicah, ki so jemale, so opazili povečano pojavnost zloma kosti pioglitazon. Med povprečnim spremljanjem 34,5 mesecev je bila incidenca zloma kosti pri ženskah 5,1% (44/870) za pioglitazon v primerjavi s 2,5% (23/905) za placebo. To razliko so opazili po prvem letu zdravljenja in je ostala med študijem. Večina zlomov, ki so jih opazili pri pacientkah, so bili nevretenčni zlomi, vključno s spodnjo in distalno zgornjo okončino. Pri moških, zdravljenih s pioglitazonom, 1,7% (30/1735) v primerjavi s placebom 2,1% (37/1728) niso opazili povečanja stopnje zloma. Tveganje za zlom je treba upoštevati pri oskrbi pacientov, zlasti žensk, ki se zdravijo pioglitazon in pozornost je treba nameniti ocenjevanju in vzdrževanju zdravja kosti v skladu s trenutnimi standardi skrbi.
Makrovaskularni rezultati: Ni nobenih kliničnih študij, ki bi potrdile zanesljive dokaze o zmanjšanju makrovaskularnega tveganja z zdravilom Actos ali katerim koli drugim zdravilom proti sladkorni bolezni.
Laboratorijski testi
FPG in HbA1c občasno je treba izvajati meritve za spremljanje glikemične kontrole in terapevtskega odziva na Actos.
Priporočljivo je spremljanje jetrnih encimov pred začetkom zdravljenja z Actosom pri vseh bolnikih in občasno po klinični presoji zdravstvenega delavca (glejte VARNOSTNI UKREPI, Splošni, jetrni učinki in NEŽELENI REAKCI, Ravni transaminaz v serumu).
Informacije za bolnike
Pomembno je, da bolnike poučite, naj se držijo prehranskih navodil in naj redno preskušajo glukozo v krvi in glikozilirani hemoglobin. V stresnih obdobjih, kot so vročina, travma, okužba ali operativni poseg, se lahko potrebe po zdravilih spremenijo, bolnike pa je treba opozoriti, naj takoj poiščejo zdravniško pomoč.
Bolniki, pri katerih pride do nenavadno hitrega povečanja teže ali edema ali pri katerih se pojavi kratka sapa ali druge simptome srčnega popuščanja, medtem ko je na Actosu, morajo te simptome takoj sporočiti svojim zdravnik.
Bolnikom je treba sporočiti, da bodo krvne preiskave delovanja jeter opravili pred začetkom zdravljenja in občasno po klinični presoji zdravstvenega delavca. Bolnikom je treba sporočiti, da takoj poiščejo zdravniško pomoč zaradi nepojasnjene slabosti, bruhanja, bolečine v trebuhu, utrujenosti, anoreksije ali temnega urina.
Bolnikom je treba povedati, da jemljejo Actos enkrat na dan. Actos lahko jemljete s hrano ali brez nje. Če en dan zamudite odmerek, se naslednji dan odmerka ne sme podvojiti.
Pri uporabi kombiniranega zdravljenja z insulinom ali peroralnimi hipoglikemičnimi zdravili, tveganji hipoglikemije, njenimi simptomi in zdravljenje in pogoje, ki so nagnjeni k njegovemu razvoju, je treba razložiti bolnikom in njihovi družini članov.
Terapija z zdravilom Actos, tako kot drugimi tiazolidindioni, lahko pri nekaterih ženskah pred menopavzo avulatorno povzroči ovulacijo. Posledično je pri teh bolnicah med jemanjem zdravila Acto morda večje tveganje za nosečnost. Zato je treba priporočiti ustrezno kontracepcijo pri ženskah pred menopavzo. V kliničnih študijah tega možnega učinka niso raziskali, zato pogostnost tega pojava ni znana.
Interakcije z zdravili
Študije interakcij med zdravili in vivo kažejo, da je pioglitazon lahko šibek induktor substrata CYP 450 izoform 3A4 (glejte KLINIČNA FARMAKOLOGIJA, Presnova in Interakcije med drogami).
Encimski inhibitor CYP2C8 (kot je gemfibrozil) lahko znatno poveča AUC za pioglitazon in encimski induktor CYP2C8 (kot je rifampin) lahko znatno zmanjšata AUC pioglitazon. Če se med zdravljenjem s pioglitazonom zavira ali ustavi zaviralec ali induktor CYP2C8, bodo morda potrebne spremembe pri zdravljenju sladkorne bolezni na podlagi kliničnega odziva (glejte KLINIČNA FARMAKOLOGIJA, Interakcije med drogami).
Kancerogeneza, mutageneza, oslabitev plodnosti
Izvedena je bila dveletna študija rakotvornosti pri samcih in samicah podgan pri peroralnih odmerkih do 63 mg / kg (približno 14-kratnik največjega priporočenega človeškega peroralnega odmerka 45 mg na osnovi mg / m2). Z zdravili povzročenih tumorjev niso opazili nobenega organa, razen sečnega mehurja. Pri samskih podganah so opazili benigne in / ali maligne neoplazme prehodnih celic pri odmerku 4 mg / kg na dan in več (približno enako največjemu priporočenemu človeškemu peroralnemu odmerku na osnovi mg / m2). Izvedena je bila dveletna študija rakotvornosti pri miših in samicah pri peroralnih odmerkih do 100 mg / kg / dan (približno 11-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na osnovi mg / m2). V nobenem organu niso opazili tumorjev, povzročenih z zdravili.
Med prospektivno oceno urinske citologije, v katero je bilo vključenih več kot 1800 bolnikov, ki so v kliničnih preskušanjih do enega leta prejemali Actos, niso ugotovili novih primerov tumorjev mehurja. V dveh triletnih študijah, v katerih so pioglitazon primerjali s placebom ali gliburidom, je bilo 16/3656 (0,44%) poročila o raku mehurja pri bolnikih, ki so jemali pioglitazon v primerjavi s 5/3679 (0,14%) pri bolnikih, ki ne jemljejo pioglitazon. Po izključitvi bolnikov, pri katerih je bila v času diagnoze raka mehurja izpostavljenost študijskemu zdravilu manjša od enega leta, je bilo šest (0,16%) primerov pioglitazona in dva (0,05%) placeba.
Pioglitazon HCl ni bil mutagen v bateriji gensko-toksikoloških študij, vključno z Amesovim bakterijskim testom, naprednim genskim celicam sesalcev mutacijski test (CHO / HPRT in AS52 / XPRT), in vitro test citogenetike z uporabo celic CHL, nenačrtovan test sinteze DNA in in vivo mikronukleus esej.
Pri peroralnih odmerkih do 40 mg / kg pioglitazona HCl na dan niso opazili škodljivih učinkov na plodnost. pred parjenjem in med nosečnostjo in brejostjo (približno 9-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na osnovi mg / m2).
Toksikologija živali
Povečanje srca so opazili pri miših (100 mg / kg), podganah (4 mg / kg in več) in psih (3 mg / kg), ki so jih peroralno uporabljali pioglitazon HCl (približno 11, 1 in 2-kratni največji priporočeni peroralni odmerek pri ljudeh za miši, podgane in pse, na osnovi mg / m2). V enoletni študiji na podganah se je zgodnja smrt zaradi drog zaradi navidezne srčne disfunkcije zgodila ob peroralni odmerek 160 mg / kg / dan (približno 35-kratni največji priporočeni peroralni odmerek pri ljudeh na podlagi mg / m2). Povečanje srca je bilo opaženo v 13-tedenski študiji pri opicah pri peroralnih odmerkih 8,9 mg / kg in več (približno 4-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na osnovi mg / m2), vendar ne v 52-tedenski študiji pri peroralnih odmerkih do 32 mg / kg (približno 13-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na osnovi mg / m2).
Nosečnost
Nosečnost kategorija C. Pioglitazon ni bil teratogen pri podganah pri peroralnih odmerkih do 80 mg / kg ali pri kuncih do 160 mg / kg med organogenezo (približno 17 in 40-kratnik največjega priporočenega odmerka pri ljudeh na mg / m2oz.). Zapoznela paritev in embriotoksičnost (kar dokazujejo povečane izgube po postplantaciji, zakasnjen razvoj in manjša teža ploda) so opazili pri podganah pri peroralnih odmerkih 40 mg / kg na dan in več (približno 10-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na podlagi mg / m2). Pri potomcih podgan niso opazili funkcionalne ali vedenjske strupenosti. Pri kuncih so opazili embriotoksičnost pri peroralnem odmerku 160 mg / kg (približno 40-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na osnovi mg / m2). Pri potomcih podgan pri peroralnih odmerkih 10 mg / kg so opazili upočasnjen poporodni razvoj, pripisan zmanjšanju telesne teže. in več v poznih obdobjih brejosti in laktacije (približno 2-kratnik največjega priporočenega peroralnega odmerka pri ljudeh na mg / m2).
Ustreznih in dobro nadzorovanih študij pri nosečnicah ni. Actos je treba uporabljati med nosečnostjo le, če potencialna korist upravičuje potencialno tveganje za plod.
Ker trenutne informacije močno kažejo, da je nenormalno raven glukoze v krvi med nosečnostjo povezano tudi z večjo pojavnostjo prirojenih anomalij, Ker povečana obolevnost in umrljivost novorojenčkov, večina strokovnjakov priporoča uporabo insulina med nosečnostjo, da se raven glukoze v krvi ohrani tako blizu kot normalna mogoče.
Doječe matere
Pioglitazon se izloča v mleku doječih podgan. Ni znano, ali Actos izloča v materinem mleku. Ker se v materino mleko izloča veliko zdravil, doječe ženske ne smemo dajati.
Uporaba pri otrocih
Varnost in učinkovitost zdravila Actos pri otrocih nista bili ugotovljeni.
Uporaba za starejše
Približno 500 bolnikov v placebo nadzorovanih kliničnih preskušanjih zdravila Actos je bilo starih 65 let in več. Med temi in mlajšimi bolniki niso opazili bistvenih razlik v učinkovitosti in varnosti.
vrh
Neželeni učinki
Več kot 8500 bolnikov s sladkorno boleznijo tipa 2 je zdravilo Actos v randomiziranih, dvojno slepih, kontroliranih kliničnih preskušanjih. To vključuje 2605 visoko tveganih bolnikov s sladkorno boleznijo tipa 2, zdravljenih z Actosom iz kliničnega preskušanja PROactive. Več kot 6000 bolnikov se zdravi 6 mesecev ali dlje in več kot 4500 bolnikov eno leto ali dlje. Več kot 3000 bolnikov je vsaj 2 leti prejemalo Actos.
Skupna incidenca in vrste neželenih učinkov, o katerih so poročali v placebo nadzorovanih kliničnih preskušanjih monoterapije z Actosom v odmerkih 7,5 mg, 15 mg, 30 mg ali 45 mg enkrat na dan, so prikazani v preglednici 7.
Tabela 7 S placebom nadzorovane klinične študije monoterapije z Actosom: Neželeni učinki so poročani pogosto - 5% bolnikov, ki se zdravijo z Actosom
| (% bolnikov) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Okužba zgornjih dihal | 8.5 | 13.2 |
| Glavobol | 6.9 | 9.1 |
| Sinusitis | 4.6 | 6.3 |
| Mialgija | 2.7 | 5.4 |
| Zobna motnja | 2.3 | 5.3 |
| Diabetes Mellitus poslabša | 8.1 | 5.1 |
| Faringitis | 0.8 | 5.1 |
Pri večini kliničnih neželenih učinkov je bila pojavnost podobna pri skupinah, zdravljenih z monoterapijo z Actosom, in tistimi, ki so jih zdravili v kombinaciji s sulfonilsečnino, metforminom in insulinom. Pri bolnikih, ki so se zdravili z Actosom in insulinom, se je povečal pojav edemov v primerjavi s samo insulinom.
V 16-tedenskem preskušanju zdravila Actos plus inzulin s placebom (n = 379) je 10 bolnikov, zdravljenih z zdravilom Actos plus inzulina se je razvila dispneja in se je v nekem trenutku med zdravljenjem razvila tudi sprememba teže ali edem Sedem od teh 10 bolnikov je dobilo diuretike za zdravljenje teh simptomov. O tem v skupini z insulinom in placebom niso poročali.
Incidenca opustitev iz placebo nadzorovanih kliničnih preskušanj zaradi neželenih dogodkov, ki niso hiperglikemija, je bila podobna pri bolnikih, zdravljenih s placebom (2,8%) ali Actos (3,3%).
V študijah nadzorovane kombinirane terapije bodisi s sulfonilsečnino bodisi z insulinom so poročali o blagi do zmerni hipoglikemiji, za katero se zdi, da je odvisna od odmerka (glejte VARNOSTNI UKREPI, Splošno, Hipoglikemija in ODMERJANJE IN UPORABA, Kombinirana terapija).
V ameriških dvojno slepih študijah so poročali o anemiji pri 2% bolnikov, zdravljenih z Actos plus sulfonilsečnino, metforminom ali insulinom (glejte VARNOSTNI UKREPI, Splošno, Hematološki).
V študijah monoterapije so poročali o edemih za 4,8% (z odmerki od 7,5 mg do 45 mg) bolnikov, zdravljenih z Actosom, v primerjavi z 1,2% bolnikov, ki so prejemali placebo. V študijah kombinirane terapije so poročali o edemih pri 7,2% bolnikov, ki so se zdravili z Actosom in sulfonilsečnino, v primerjavi z 2,1% bolnikov, ki so prejemali samo sulfonilsečnine. V študijah kombinirane terapije z metforminom so poročali o edemih pri 6,0% bolnikov na kombiniranem zdravljenju v primerjavi z 2,5% bolnikov, ki so prejemali samo metformin. V študijah kombinirane terapije z insulinom so poročali o edemih pri 15,3% bolnikov na kombiniranem zdravljenju v primerjavi s 7,0% bolnikov, ki so prejemali samo insulin. Večina teh dogodkov je veljala za blago ali zmerno intenzivnost (glej VARNOSTNI UKREPI, Splošno, Edema).
V enem 16-tedenskem kliničnem preskušanju kombiniranega zdravljenja z insulinom in Actosom je več bolnikov na kombiniranem zdravljenju razvilo kongestivno srčno popuščanje (1,1%) v primerjavi z nobenim samo na insulinu (glejte OPOZORILA, Srčna okvara in drugi srčni učinki).
Možno klinično preskušanje pioglitazona pri makrovaskularnih dogodkih (proaktivno)
V skupini PROactive je bilo 5238 bolnikov s sladkorno boleznijo tipa 2 in predhodno makrovaskularno boleznijo v preteklosti zdravljeni z Actosom (n = 2605), ki ga poleg standardnega titrirajo do 45 mg dnevno ali s placebom (n = 2633) skrbi. Skoraj vsi preiskovanci (95%) so prejemali kardiovaskularna zdravila (beta blokatorji, zaviralci ACE, ARB, zaviralci kalcijevih kanalov, nitrati, diuretiki, aspirin, statini, fibrati). Bolniki so imeli povprečno starost 61,8 leta, povprečno trajanje sladkorne bolezni 9,5 let, povprečno HbA1c pa 8,1%. Povprečno trajanje spremljanja je bilo 34,5 meseca. Glavni cilj tega preskusa je bil preučiti vpliv Actos na smrtnost in makrovaskularna obolevnost pri bolnikih z diabetesom mellitusom tipa 2, ki so bili visoko ogroženi makrovaskularni dogodki. Primarna spremenljivka učinkovitosti je bil čas do prvega pojava katerega koli dogodka v kardiovaskularni sestavljeni končni točki (glejte spodnjo tabelo 8). Čeprav ni bilo statistično pomembne razlike med Actosom in placebom za 3-letno pojavnost Prvi dogodek znotraj tega sestavka ni bil povečan umrljivosti ali skupnih makrovaskularnih dogodkov s Actos.
Tabela 8 Število prvih in skupnih dogodkov za vsako komponento znotraj kardiovaskularne sestavljene končne točke
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Kardiovaskularni dogodki | Prvi dogodki (N) |
Skupaj dogodkov (N) |
Prvi dogodki (N) |
Skupaj dogodkov (N) |
| Vsak dogodek | 572 | 900 | 514 | 803 |
| Smrtnost zaradi vseh vzrokov | 122 | 186 | 110 | 177 |
| Nefatalni MI | 118 | 157 | 105 | 131 |
| Stroka | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Srčna intervencija | 101 | 240 | 101 | 195 |
| Velika amputacija nog | 15 | 28 | 9 | 28 |
| Revaskularizacija nog | 57 | 92 | 71 | 115 |
Prejeta so bila tudi poročila o trženju po novem ali poslabšanju diabetičnega makularnega edema z zmanjšano ostrino vida (glej VARNOSTNI UKREPI, Splošno, Makularni edem).
Laboratorijske nepravilnosti
Hematološki: Actos lahko povzroči znižanje hemoglobina in hematokrita. Zdi se, da je padec hemoglobina in hematokrita z zdravilom Actos odvisen od odmerka. V vseh kliničnih študijah so se povprečne vrednosti hemoglobina znižale za 2% do 4% pri bolnikih, zdravljenih z Actosom. Te spremembe so se na splošno pojavile v prvih 4 do 12 tednih zdravljenja in so ostale relativno stabilne. Te spremembe so lahko povezane s povečanim plazemskim volumnom, povezanim z zdravljenjem z Actosom, in so le redko povezane s pomembnimi hematološkimi kliničnimi učinki.
Ravni transaminaz v serumu: Med vsemi kliničnimi študijami v ZDA je imelo 14 od 4780 (0,30%) bolnikov, zdravljenih z Actos, vrednosti ALT, 3-krat večjo od zgornje meje normale med zdravljenjem. Vsi bolniki z vrednostmi spremljanja so imeli povratno zvišanje ALT. V populaciji bolnikov, ki se zdravijo z Actosom, so se povprečne vrednosti bilirubina, AST, ALT, alkalne fosfataze in GGT zmanjšale na končnem obisku v primerjavi z izhodiščnimi vrednostmi. Manj kot 0,9% bolnikov, zdravljenih z Actosom, je bilo zaradi nenormalnih testov jetrne funkcije umaknjeno iz kliničnih preskušanj v ZDA.
V kliničnih preskušanjih pred odobritvijo ni bilo primerov idiosinkratskih reakcij zdravil, ki bi privedle do odpovedi jeter (glej) VARNOSTNI UKREPI, Splošni, jetrni učinki).
Ravni CPK: Med zahtevanimi laboratorijskimi testi v kliničnih preskušanjih so opažali sporadične, prehodne zvišanja ravni kreatin fosfokinaze (CPK). Pri 9 bolnikih (vrednosti 2150 do 11400 ie / l) so opazili izolirano višino nad 10-krat večjo zgornjo mejo normale. Šest od teh bolnikov je še naprej prejemalo zdravilo Actos, dva pa sta končala študijo zdravila v času povišane vrednosti in en bolnik je zaradi prekinitve prekinil študijsko zdravljenje nadmorska višina. Te višine so odpravile brez očitnih kliničnih posledic. Povezava teh dogodkov s terapijo z Actosom ni znana.
vrh
Predoziranje
Med nadzorovanimi kliničnimi preskušanji so poročali o enem primeru prevelikega odmerjanja zdravila Actos. Moški bolnik je štiri dni jemal 120 mg na dan, nato 180 mg na dan sedem dni. Bolnik je v tem obdobju zanikal kakršne koli klinične simptome.
V primeru prevelikega odmerjanja je treba začeti ustrezno podporno zdravljenje glede na bolnikove klinične znake in simptome.
vrh
Odmerjanje in uporaba
Actos je treba jemati enkrat na dan, ne glede na obroke.
Vodenje antidiabetične terapije mora biti individualizirano. V idealnem primeru bi morali odziv na terapijo oceniti z uporabo HbA1c kar je boljši pokazatelj dolgoročne kontrole glikemije kot sam FPG. HbA1c odraža glikemijo v zadnjih dveh do treh mesecih. Pri klinični uporabi je priporočljivo, da se bolniki zdravijo z Actosom v obdobju, ki je primerno za oceno spremembe HbA1c (tri mesece), razen če se kontrola glikemije poslabša. Po uvedbi zdravila Actos ali s povečanjem odmerka je treba bolnike skrbno nadzorovati zaradi neželenih učinkov, povezanih z zastajanjem tekočine (glejte OKVIRNO OPOZORILO in OPOZORILA).
Monoterapija
Monoterapija z actosom pri bolnikih, ki niso pravilno nadzorovani s prehrano in telesno aktivnostjo, se lahko začne s 15 mg ali 30 mg enkrat na dan. Za bolnike, ki se ne odzivajo na začetni odmerek zdravila Actos, je mogoče odmerek povečati do 45 mg enkrat na dan. Pri bolnikih, ki se na monoterapijo ne odzivajo ustrezno, je treba razmisliti o kombiniranem zdravljenju.
Kombinirana terapija
Sulfonilsečnine: Actos v kombinaciji s sulfonilsečnino lahko začnemo s 15 mg ali 30 mg enkrat na dan. Sedanji odmerek sulfonilsečnine se lahko nadaljuje po začetku zdravljenja z Actosom. Če bolniki poročajo o hipoglikemiji, je treba odmerek sulfonilsečnine zmanjšati.
Metformin: Actos v kombinaciji z metforminom lahko začnemo s 15 mg ali 30 mg enkrat na dan. Trenutni odmerek metformina se lahko nadaljuje po začetku zdravljenja z Actosom. Malo je verjetno, da se bo odmerek metformina med kombiniranim zdravljenjem z zdravilom Actos moral prilagoditi zaradi hipoglikemije.
Insulin: Actos v kombinaciji z insulinom lahko začnemo s 15 mg ali 30 mg enkrat na dan. Sedanji odmerek insulina lahko nadaljujemo po začetku zdravljenja z Actosom. Pri bolnikih, ki prejemajo Actos in inzulin, se lahko odmerek insulina zmanjša za 10% do 25%, če bolnik poroča o hipoglikemiji ali če plazemske koncentracije glukoze padejo na manj kot 100 mg / dL. Nadaljnje prilagoditve je treba individualizirati na podlagi odziva na znižanje glukoze.
Največji priporočeni odmerek
Odmerek zdravila Actos pri monoterapiji ali v kombinaciji s sulfonilsečnino, metforminom ali insulinom ne sme presegati 45 mg enkrat na dan.
Prilagajanje odmerka pri bolnikih z ledvično insuficienco ni priporočljivo (glejte KLINIČNA FARMAKOLOGIJA, Farmakokinetika in presnova zdravil).
Terapije z zdravilom Actos se ne sme začeti, če ima bolnik klinične dokaze o aktivni jetrni bolezni ali zvišane ravni transaminaze v serumu (ALT je več kot 2,5-krat večja od zgornje meje normalne vrednosti) na začetku terapije (glej VARNOSTNI UKREPI, Splošni, jetrni učinki in KLINIČNA FARMAKOLOGIJA, Posebne populacije, insuficienca jeter). Spremljanje jetrnih encimov je priporočljivo pri vseh bolnikih pred začetkom zdravljenja z zdravilom Actos in občasno po njem (glejte VARNOSTNI UKREPI, Splošni, jetrni učinki).
Podatkov o uporabi zdravila Actos pri bolnikih, mlajših od 18 let, ni; zato uporaba zdravila Actos pri otrocih ni priporočljiva.
Ni podatkov o uporabi zdravila Actos v kombinaciji z drugim tiazolidindionom.
vrh
Kako dobavljeno
Actos je na voljo v tabletah 15 mg, 30 mg in 45 mg, kot sledi:
15 mg tableta: bela do sivo bela, okrogla, konveksna, nedorečena tableta z napisom "Actos" na eni strani in "15" na drugi strani, na voljo v:
NDC 64764-151-04 Steklenice po 30
NDC 64764-151-05 Steklenice 90
NDC 64764-151-06 Steklenice po 500
30 mg tableta: bela do skoraj bela, okrogla, ploščata, neobrezana tableta z napisom "Actos" na eni strani in "30" na drugi strani, na voljo v:
NDC 64764-301-14 Steklenice po 30
NDC 64764-301-15 Steklenice po 90
NDC 64764-301-16 Steklenic po 500
45 mg tableta: bela do skoraj bela, okrogla, ploščata, neobrezana tableta z napisom "Actos" na eni strani in "45" na drugi strani, na voljo v:
NDC 64764-451-24 Steklenice po 30
NDC 64764-451-25 Steklenice 90
NDC 64764-451-26 Steklenice po 500
SKLADIŠČENJE
Shranjujte pri 25 ° C; dovoljeni izleti do 15-30 ° C (glej USP nadzorovana temperatura prostora). Posodo hraniti tesno zaprto in zaščititi pred vlago in vlago.
vrh
Reference
- Deng, LJ in sod. Vpliv gemfibrozila na farmakokinetiko pioglitazona. Eur J Clin Pharmacol 2005; 61: 831-836, tabela 1.
2. Jaakkola, T in sod. Vpliv rifampicina na farmakokinetiko pioglitazona. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Samo Rx
Proizvajalec:
Takeda Pharmaceutical Company Limited
Osaka, Japonska
Tržilec:
Takeda Pharmaceuticals America, Inc.
En park Takeda
Deerfield, IL 60015
Actos® je registrirana blagovna znamka družbe Takeda Pharmaceutical Company Limited in jo pod licenco uporablja družba Takeda Pharmaceuticals America, Inc.
Vsa druga imena blagovnih znamk so last njihovih lastnikov.
Zadnja posodobitev: 8. 9.
Actos, pioglitazon hcl, podatki o bolniku (v navadni angleščini)
Podrobne informacije o znakih, simptomih, vzrokih, zdravljenju sladkorne bolezni
Informacije v tej monografiji ne zajemajo vseh možnih načinov uporabe, navodil, previdnostnih ukrepov, interakcij z zdravili ali škodljivih učinkov. Te informacije so posplošene in niso mišljene kot poseben zdravniški nasvet. Če imate vprašanja o zdravilih, ki jih jemljete ali bi želeli več informacij, se posvetujte s svojim zdravnikom, farmacevtom ali medicinsko sestro.
nazaj k: Preglejte vsa zdravila za zdravljenje sladkorne bolezni


