Avandia za zdravljenje sladkorne bolezni
Blagovna znamka: AVANDIA
Generično ime: rosiglitazon maleat
Vsebina:
Indikacije in uporaba
Odmerjanje in uporaba
Odmerne oblike in prednosti
Kontraindikacije
Opozorila in previdnostni ukrepi
Neželeni učinki
Interakcije z zdravili
Uporaba v specifičnih populacijah
Preveliko odmerjanje
Opis
Klinična farmakologija
Neklinična toksikologija
Klinične študije
Kako dobavljeno
Avandia, rosiglitazon maleat, podatki o bolniku (v navadni angleščini)
OPOZORILO
KONGESTIVNA NESREČA SRCA IN MIKOKARDNA ISHEMIJA
- Tiazolidindioni, vključno z rosiglitazonom, pri nekaterih bolnikih povzročajo ali poslabšajo kongestivno srčno popuščanje [glej OPOZORILA IN VARNOSTNI UKREPI]. Po uvedbi zdravila AVANDIA in po zvišanju odmerka pazljivo opazujte bolnike glede znakov in simptomov srčnega popuščanja (vključno s čezmernim, hitrim pridobivanjem telesne mase, dispnejo in / ali edemom). Če se ti znaki in simptomi razvijejo, je treba srčno popuščanje obvladovati v skladu s trenutnimi standardi oskrbe. Poleg tega je treba razmisliti o ukinitvi ali zmanjšanju odmerka zdravila AVANDIA.
- Zdravila AVANDIA ne priporočamo bolnikom s simptomatskim srčnim popuščanjem. Začetek zdravljenja z zdravilom AVANDIA pri bolnikih z ugotovljenim srčnim popuščanjem razreda III ali IV NYHA je kontraindicirano. [Glej KONTRAINDIKACIJE in OPOZORILA IN VARNOSTNI UKREPI.]
- Metaanaliza 42 kliničnih študij (povprečno trajanje 6 mesecev; 14.237 skupnih bolnikov), ki so večinoma primerjali zdravilo AVANDIA s placebom, so pokazali, da je AVANDIA povezana s povečanim tveganjem za ishemične dogodke miokarda, kot sta angina ali miokardni infarkt. Tri druge študije (povprečno trajanje 41 mesecev; 14.067 skupaj bolnikov), če primerjajo AVANDIA z nekaterimi drugimi odobrenimi peroralnimi antidiabetiki ali placebom, tega tveganja niso potrdili ali izključili. Razpoložljivi podatki o tveganju za miokardno ishemijo v celoti niso prepričljivi. [Glej OPOZORILA IN VARNOSTNI UKREPI.]
vrh
Indikacije in uporaba
Monoterapija in kombinirana terapija
Zdravilo AVANDIA je indicirano kot dodatek k prehrani in telesni vadbi za izboljšanje nadzora glikemije pri odraslih z diabetesom mellitusom tipa 2.
Pomembne omejitve uporabe
- AVANDIA je zaradi svojega mehanizma delovanja aktiven le v prisotnosti endogenega insulina. Zato zdravila AVANDIA ne smemo uporabljati pri bolnikih z diabetesom mellitusom tipa 1 ali za zdravljenje diabetične ketoacidoze.
- Sočasna uporaba zdravila AVANDIA in insulina ni priporočljiva.
- Uporaba zdravila AVANDIA z nitrati ni priporočljiva.
vrh
Odmerjanje in uporaba
Vodenje antidiabetične terapije mora biti individualizirano. Vsi bolniki morajo začeti zdravilo AVANDIA z najnižjim priporočenim odmerkom. Nadaljnje povečanje odmerka zdravila AVANDIA mora spremljati skrbno spremljanje neželenih učinkov, povezanih z zastajanjem tekočine [glejte Opozorilno sporočilo in OPOZORILA IN VARNOSTNI UKREPI].
Zdravilo AVANDIA se lahko daje v začetnem odmerku 4 mg bodisi kot enkraten dnevni odmerek bodisi v dveh deljenih odmerkih. Za bolnike, ki se odzivajo neustrezno po 8 do 12 tednih zdravljenja, kar je določeno z zmanjšanjem glukoze v plazmi na tešče (FPG) se lahko odmerek poveča na 8 mg dnevno kot monoterapija ali v kombinaciji z metforminom, sulfonilsečnino ali sulfonilsečnino plus metformin. Zmanjšanje glikemičnih parametrov glede na odmerek in režim je opisano v Kliničnih študijah. Zdravilo AVANDIA se lahko jemlje s hrano ali brez nje.
Skupni dnevni odmerek zdravila AVANDIA ne sme presegati 8 mg.
Monoterapija
Običajni začetni odmerek zdravila AVANDIA je 4 mg, ki ga dajemo kot en odmerek enkrat na dan ali v deljenih odmerkih dvakrat na dan. V kliničnih preskušanjih je 4-mg dvakrat na dan privedlo do največjega zmanjšanja FPG in hemoglobina A1c (HbA1c).
Kombinacija s sulfonilsečnino ali metforminom
Ko dodamo zdravilo AVANDIA obstoječemu zdravljenju, lahko trenutni odmerek zdravil nadaljujemo po začetku zdravljenja z zdravilom AVANDIA.
Sulfonilsečnina: Kadar se uporablja v kombinaciji s sulfonilsečnino, je običajni začetni odmerek AVANDIA 4 mg, ki ga dajemo kot en odmerek enkrat na dan ali v deljenih odmerkih dvakrat na dan. Če bolniki poročajo o hipoglikemiji, je treba odmerek sulfonilsečnine zmanjšati.
Metformin: Običajni začetni odmerek zdravila AVANDIA v kombinaciji z metforminom je 4 mg, ki ga dajemo kot enkratni odmerek enkrat na dan ali v deljenih odmerkih dvakrat na dan. Malo je verjetno, da se bo odmerek metformina med kombiniranim zdravljenjem z zdravilom AVANDIA prilagodil zaradi hipoglikemije.
Kombinacija z metforminom Sulfonilurea Plus
Običajni začetni odmerek zdravila AVANDIA v kombinaciji s sulfonilsečnino in metforminom je 4 mg, ki ga dajemo v obliki enkratnega odmerka enkrat na dan ali v odmerkih dvakrat na dan. Če bolniki poročajo o hipoglikemiji, je treba odmerek sulfonilsečnine zmanjšati.
Specifične populacije bolnikov
Ledvična okvara: Pri uporabi AVANDIA kot monoterapije pri bolnikih z okvaro ledvic prilagajanje odmerka ni potrebno. Ker je metformin pri takih bolnikih kontraindiciran, je sočasno jemanje metformina in AVANDIA kontraindicirano tudi pri bolnikih z okvaro ledvic.
Okvara jeter: Pred začetkom zdravljenja z zdravilom AVANDIA je treba izmeriti jetrne encime. Terapije z zdravilom AVANDIA se ne sme začeti, če ima bolnik klinične dokaze, da so aktivni bolezni jeter ali zvišane ravni transaminaze v serumu (ALT> 2,5X zgornja meja normale na začetku terapija). Po uvedbi zdravila AVANDIA je treba jetrne encime periodično spremljati glede na klinično presojo zdravstvenega delavca. [Glej OPOZORILA IN VARNOSTNI UKREPI in KLINIČNA FARMAKOLOGIJA.]
Otroški: Podatkov ni dovolj, da bi priporočali uporabo AVANDIA pri otrocih [glej UPORABITE V POSEBNIH STANOVANJIH].
vrh
Odmerne oblike in jakosti
Peterokotna filmsko obložena tableta TILTAB vsebuje rosiglitazon kot maleat:
- 2 mg - roza, vtisnjeno s SB na eni strani in 2 na drugi strani
- 4 mg - oranžna, vtisnjena s SB na eni strani in 4 na drugi strani
- 8 mg - rdeče-rjave barve, vtisnjene s SB na eni strani in 8 na drugi strani
vrh
Kontraindikacije
Začetek zdravljenja z zdravilom AVANDIA pri bolnikih s sedežem New York Heart Association (NYHA) srčnega popuščanja razreda III ali IV je kontraindiciran [glejte OKVIRNO OPOZORILO].
vrh
Opozorila in previdnostni ukrepi
Srčna okvara
AVANDIA lahko, tako kot drugi tiazolidindioni, sama ali v kombinaciji z drugimi antidiabetiki povzroči zastajanje tekočine, kar lahko poslabša ali privede do srčnega popuščanja. Bolnike je treba opazovati zaradi znakov in simptomov srčnega popuščanja. Če se ti znaki in simptomi razvijejo, je treba srčno popuščanje obvladovati v skladu s trenutnimi standardi oskrbe. Poleg tega je treba razmisliti o ukinitvi ali zmanjšanju odmerka rosiglitazona [glej OKVIRNO OPOZORILO].
Bolniki s kongestivnim srčnim popuščanjem (CHF) NYHA razreda I in II, ki se zdravijo z zdravilom AVANDIA, imajo povečano tveganje za srčno-žilne dogodke. Izvedena je bila 52-tedenska dvojno slepa, s placebom nadzorovana ehokardiografska študija pri 224 bolnikih s tipom 2 diabetes mellitus in NYHA razreda I ali II CHF (izmetni delež ‰ ¤ 45%) pri antidiabetiki in CHF terapija. Neodvisni odbor je izvedel slepo oceno dogodkov, povezanih s tekočino (vključno z) kongestivno srčno popuščanje) in kardiovaskularne hospitalizacije po vnaprej določenih merilih (sodba). Preiskovalci so poročali o drugih neželenih učinkih na srčno-žilni sistem, ločenih od odločitve. Čeprav niso opazili razlike v zdravljenju glede na izhodiščne vrednosti izmetnih frakcij, več Po zdravljenju z zdravilom AVANDIA so opazili neželene učinke srca in ožilja v primerjavi s placebom med 52-tedenska študija. (Glej tabelo 1.)
Tabela 1. Nujni neželeni učinki kardiovaskularnega sistema pri bolnikih s kongestivnim srčnim popuščanjem (razrede I in II NYHA), ki se zdravijo z zdravilom AVANDIA ali placebom (poleg terapije z antidiabetiki in CHF)
| Dogodki | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| Predsodki | ||
| Kardiovaskularne smrti | 5 (5%) | 4 (4%) |
| Poslabšanje CHF | 7 (6%) | 4 (4%) |
| - z hospitalizacijo čez noč | 5 (5%) | 4 (4%) |
| - brez hospitalizacije čez noč | 2 (2%) | 0 (0%) |
| Novi ali poslabšani edemi | 28 (25%) | 10 (9%) |
| Nova ali poslabšana dispneja | 29 (26%) | 19 (17%) |
| Povečanje CHF zdravil | 36 (33%) | 20 (18%) |
| Srčno-žilna hospitalizacija * | 21 (19%) | 15 (13%) |
| Poročajo preiskovalci, ki niso bili obravnavani | ||
| Ishemični neželeni učinki | 10 (9%) | 5 (4%) |
| - infarkt miokarda | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Vključuje hospitalizacijo iz katerega koli srčno-žilnega razloga. |
Začetek zdravljenja z zdravilom AVANDIA pri bolnikih z ugotovljenim srčnim popuščanjem razreda III ali IV NYHA je kontraindicirano. Zdravila AVANDIA ne priporočamo bolnikom s simptomatskim srčnim popuščanjem. [Glej OKVIRNO OPOZORILO.]
Bolnikov z akutnim koronarnim sindromom niso preučevali v kontroliranih kliničnih preskušanjih. Glede na možnost razvoja srčnega popuščanja pri bolnikih, ki imajo akutni koronarni dogodek, začetek zdravila AVANDIA ni priporočljivo za bolnike, ki imajo akutni koronarni dogodek in je treba zdravljenje AVANDIA v tej akutni fazi prekiniti šteje.
Bolnikov s srčnim stanjem razreda NYHA III in IV (s CHF ali brez) niso preučevali v kontroliranih kliničnih preskušanjih. Zdravila AVANDIA ne priporočamo bolnikom s srčnim stanjem razreda III in IV NYHA.
Miokardna ishemija
Metaanaliza miokardne ishemije v skupini 42 kliničnih preskušanj
Za nazaj je bila izvedena metaanaliza za oceno srčno-žilnih neželenih dogodkov, o katerih so poročali v 42 dvojno slepih, randomiziranih, kontroliranih kliničnih preskušanjih (povprečno trajanje 6 mesecev).1
Te študije so bile izvedene za oceno učinkovitosti zniževanja glukoze pri sladkorni bolezni tipa 2 in v preskušanjih ni prišlo do načrtovanega načrtovanja presoje srčno-žilnih dogodkov. Nekatera preskušanja so bila nadzorovana s placebom, nekatera pa so kot kontrolna zdravila uporabila aktivna peroralna antidiabetična zdravila. S placebom nadzorovane študije so vključevale preskušanja monoterapije (monoterapija z AVANDIA proti placebo monoterapijo) in dodatna preskušanja (AVANDIA ali placebo, dodana sulfonilsečnini, metforminu ali insulinu). Študije aktivne kontrole so vključevale preskušanja monoterapije (monoterapija z zdravilom AVANDIA v primerjavi s sulfonilsečnino ali metforminom monoterapija) in dodatna preskušanja (AVANDIA plus sulfonilsečnina ali AVANDIA plus metformin v primerjavi s sulfonilsečnino plus metformin). Skupaj je bilo vključenih 14.237 bolnikov (8.604 v skupine zdravljenja, ki so vsebovale AVANDIA, 5.633 in primerjalne skupine), pri čemer je bilo 4.143 bolniških let izpostavljenosti AVANDIA in 2675 bolniških let izpostavljenosti primerjalnik. Miokardni ishemični dogodki vključujejo angino pektoris, poslabšano angino pektoris, nestabilno angino, srčni zastoj, bolečino v prsih, koronarno okluzija arterije, dispneja, miokardni infarkt, koronarna tromboza, miokardna ishemija, koronarna bolezen in koronarna arterija motnja. V tej analizi je bilo povečano tveganje za miokardno ishemijo z AVANDIA v primerjavi s skupnimi primerjalniki opazili (2% AVANDIA v primerjavi z 1,5% primerjalniki, razmerje kvot 1,4, 95% interval zaupanja [CI] 1,1, 1.8). V placebo-nadzorovanih študijah so opazili povečano tveganje za miokardne ishemične dogodke z zdravilom AVANDIA, ne pa tudi v študijah z aktivnim nadzorom. (Glej sliko 1.)
V študijah, ki so jim dodali zdravilo AVANDIA, so opazili večje povečano tveganje za pojav miokardnih ishemičnih dogodkov do insulina (2,8% za AVANDIA plus inzulin v primerjavi z 1,4% za placebo plus inzulin, [ALI 2,1, 95% CI 0,9, 5.1]). To povečano tveganje odraža razliko v 3 dogodkih na 100 bolniških let (95% CI -0,1, 6,3) med skupinami zdravljenja. [Glej OPOZORILA IN VARNOSTNI UKREPI.]
Slika 1. Gozdna parcela koeficientov (95-odstotni intervali zaupanja) za miokardne ishemične dogodke v metaanalizi 42 kliničnih preskušanj

Večje povečano tveganje za miokardno ishemijo so opazili tudi pri bolnikih, ki so prejemali zdravilo AVANDIA in zdravljenje z nitrati v ozadju. Za uporabnike nitratov AVANDIA (N = 361) v primerjavi s kontrolo (N = 244) je bilo razmerje kvote 2,9 (95% CI 1,4, 5,9), medtem ko je bilo za uporabnike ne-nitratov (skupaj približno 14 000 bolnikov) kvota 1,3 (95% CI 0,9, 1.7). To povečano tveganje predstavlja razliko med 12 miokardnimi ishemičnimi dogodki na 100 bolniških let (95% CI 3.3, 21.4). Večina uporabnikov nitratov je imela koronarno srčno bolezen. Med bolniki z znano koronarno srčno boleznijo, ki niso bili na terapiji z nitrati, povečano tveganje za miokardne ishemične dogodke za AVANDIA v primerjavi s primerjalnikom ni bilo dokazano.
Miokardni ishemični dogodki v velikih dolgoročnih perspektivnih randomiziranih kontroliranih preskušanjih AVANDIA
Podatke iz treh drugih velikih, dolgoročnih, perspektivnih, randomiziranih, kontroliranih kliničnih preskušanj zdravila AVANDIA smo ocenili ločeno od metaanalize. Ta tri preskušanja vključujejo skupno 14.067 bolnikov (skupine zdravljenja, ki vsebujejo AVANDIA N = 6.311, primerjalnik skupine N = 7 756) z izpostavljenostjo 21 803 bolniških let za zdravilo AVANDIA in 25 998 bolniških let za primerjalnik. Trajanje spremljanja je v vsaki študiji preseglo 3 leta. ADOPT (Diabetes Outunities Progression Trial) je bila 4- do 6-letna randomizirana, aktivno nadzorovana študija pri nedavno diagnosticiranih bolnikih s sladkorno boleznijo tipa 2 na zdravljenje z zdravili.
Preizkus učinkovitosti in splošne varnosti je bil zasnovan za preučitev trajnosti
AVANDIA kot monoterapija (N = 1,456) za nadzor glikemije pri sladkorni bolezni tipa 2, s primerjalno skupino monoterapije s sulfonilsečnino (N = 1,441) in monoterapijo z metforminom (N = 1,454). DREAM (ocena zmanjšanja sladkorne bolezni z zdravilom Rosiglitazon in zdravilom Ramipril z zdravili, objavljeno poročilo2) je bila od 3 do 5-letna randomizirana, s placebom nadzorovana študija pri bolnikih z oslabljeno toleranco za glukozo in / ali oslabljeno na tešče glukoza. Imel je 2x2 faktorski načrt, namenjen ocenjevanju učinka AVANDIA in ločeno od ramiprila (zaviralca angiotenzinskega pretvorbe [ACEI]) na napredovanje k očitni sladkorni bolezni. V skupini DREAM je bilo 2635 bolnikov v skupinah, ki so vsebovale AVANDIA, in 2634 v skupinah, ki niso imele zdravljenja AVANDIA.Interim rezultati so bili objavljeni 3 za RECORD (Rosiglitazon, ocenjen za srčne izide in uravnavanje glikemije v Diabetes), tekoča 6-letna študija o srčno-žilnih izvidih pri bolnikih s sladkorno boleznijo tipa 2 s povprečnim zdravljenjem trajanje 3,75 leta. RECORD vključuje bolnike, ki niso uspeli z monoterapijo z metforminom ali sulfonilsečnino; tisti, ki niso prejeli metformina, so naključno prejeli dodatek AVANDIA ali dodatni sulfonilsečnino, tisti, ki niso imeli sulfonilsečnine, pa so naključno prejeti bodisi dodatek AVANDIA bodisi dodatek metformin. V sistemu RECORD skupno 2.220 bolnikov prejema dodatek AVANDIA, in 2.227 bolnikov je v enem od režimov dodatkov, ki ne vsebujejo AVANDIA.
V teh treh preskušanjih so bile izvedene analize z uporabo sestavka večjih neželenih srčno-žilnih dogodkov (miokardni infarkt, srčno-žilna smrt ali kap), v nadaljnjem besedilu MACE. Ta končna točka se je razlikovala od široke končne točke metaanalize miokardnih ishemičnih dogodkov, od tega več kot polovica angine. Miokardni infarkt vključuje sodni smrtni in nefatalni miokardni infarkt plus nenadno smrt. Kot je prikazano na sliki 2, se rezultati za 3 končne točke (MACE, MI in skupna umrljivost) statistično ne razlikujejo med AVANDIA in primerjalniki.

V predhodnih analizah preskušanja DREAM je bila incidenca srčno-žilnih dogodkov večja med preiskovanci, ki so prejeli zdravilo AVANDIA v kombinaciji z ramiprilom kot med osebami, ki so prejemale sam ramipril, kot je prikazano v Slika 2 Te ugotovitve niso potrdili v ADOPT in RECORD (aktivno kontrolirani preskušanji pri bolnikih s sladkorno boleznijo), pri katerih je 30% oziroma 40% bolnikov poročalo o uporabi zaviralca ACE.
Razpoložljivi podatki o tveganju za miokardno ishemijo v celoti niso prepričljivi. Dokončne ugotovitve glede tega tveganja čakajo na zaključek ustrezno zasnovane študije o kardiovaskularnem izidu.
Kliničnih študij, ki bi potrjevale dokončne dokaze o zmanjšanju makrovaskularnega tveganja z zdravilom AVANDIA ali katerim koli drugim peroralnim antidiabetikom, ni bilo.
Zastojno srčno popuščanje in miokardna ishemija med sočasno uporabo zdravila AVANDIA z insulinom
V študijah, v katerih so AVANDIA dodali inzulin, je zdravilo AVANDIA povečalo tveganje za kongestivno srčno popuščanje in miokardno ishemijo. (Glej tabelo 2.)
Sočasna uporaba zdravila AVANDIA in insulina ni priporočljiva. [Glej Indikacije in uporaba in OPOZORILA IN VARNOSTNI UKREPI.]
V petih, 26-tedenskih, kontroliranih, randomiziranih dvojno slepih preskušanjih, ki so bile vključene v metaanalizo [glej OPOZORILA IN VARNOSTNI UKREPI] so bili bolniki z diabetesom mellitusom tipa 2 naključno razvrščeni po sočasni uporabi zdravila AVANDIA in insulina (N = 867) ali insulina (N = 663). V teh 5 preskušanjih so AVANDIA dodali inzulin. Ta preskušanja so vključevala bolnike z dolgotrajno sladkorno boleznijo (povprečno trajanje 12 let) in visoko razširjenostjo že obstoječe zdravstvena stanja, vključno s periferno nevropatijo, retinopatijo, ishemično boleznijo srca, vaskularno boleznijo in zastojnim srcem neuspeh. Skupno število bolnikov z nastajajočim kongestivnim srčnim popuščanjem je bilo 21 (2,4%) in 7 (1,1%) v skupini AVANDIA plus inzulin in insulin. Skupno število bolnikov z nastajajočo miokardno ishemijo je bilo 24 (2,8%) in 9 (1,4%) v skupini AVANDIA plus inzulin in insulin (OR 2,1 [95% IZ 0,9, 5,1]). Čeprav je bila stopnja dogodkov za kongestivno srčno popuščanje in miokardno ishemijo v raziskavi nizka število prebivalcev, dosledno je bila ob sočasni uporabi AVANDIA in AVANDIA stopnja dogodkov dvakrat večja ali večja inzulina. Ti kardiovaskularni dogodki so bili opaženi pri dnevnih odmerkih zdravila AVANDIA v odmerku 4 mg in 8 mg. (Glej tabelo 2.)
Tabela 2 Pojav srčno-žilnih dogodkov v 5 nadzorovanih preskušanjih dodajanja zdravila AVANDIA k uveljavljenemu insulinskemu zdravljenju
| Dogodek * | AVANDIA + inzulin (n = 867) n (%) |
Inzulin (n = 663) n (%) |
| Postopno srčno popuščanje | 21 (2.4%) | 7 (1.1%) |
| Miokardna ishemija | 24 (2.8%) | 9 (1.4%) |
| Sestavljen iz srčno-žilne smrti, miokardnega infarkta ali možganske kapi | 10 (1.2%) | 5 (0.8%) |
| Stroka | 5 (0.6%) | 4 (0.6%) |
| Infarkt miokarda | 4 (0.5%) | 1 (0.2%) |
| Kardiovaskularna smrt | 4 (0.5%) | 1 (0.2%) |
| Vse smrti | 6 (0.7%) | 1 (0.2%) |
| * Dogodki niso ekskluzivni; tj. bolnika s srčno-žilno smrtjo zaradi miokardnega infarkta bi šteli v 4 kategorije dogodkov (miokardna ishemija; smrt srca in ožilja, miokardni infarkt ali kap; miokardni infarkt; smrt srca in ožilja). |
V šestem, 24-tedenskem, nadzorovanem, randomiziranem, dvojno slepem preskušanju zdravila AVANDIA in sočasni uporabi insulina smo inzulin dodali v AVANDAMET® (rosiglitazon maleat in metformin HCl) (n = 161) in v primerjavi z insulinom plus placebom (n = 158), po enkratnem slepem 8-tedenskem zagonu z AVANDAMET. Bolniki z edemi, ki potrebujejo farmakološko terapijo, in tisti s kongestivnim srčnim popuščanjem so bili v izhodišču in med obdobjem izvzetja izključeni.
V skupini, ki je prejemala AVANDAMET plus inzulin, je bil en miokardni ishemični dogodek in ena nenadna smrt. V skupini z insulinom niso opažali miokardne ishemije in v nobeni od zdravljenih skupin niso poročali o kongestivnem srčnem popuščanju.
Edem
Zdravilo AVANDIA je treba uporabljati previdno pri bolnikih z edemi. V klinični študiji pri zdravih prostovoljcih, ki so 8 tednov prejemali 8 mg AVANDIA enkrat na dan, je prišlo do statistično značilnega povečanja mediane plazemske količine v primerjavi s placebom.
Ker tiazolidindioni, vključno z rosiglitazonom, lahko povzročijo zastajanje tekočine, kar lahko poslabša oz. privede do kongestivnega srčnega popuščanja, je treba zdravilo AVANDIA uporabljati previdno pri bolnikih, pri katerih obstaja tveganje za srčno popuščanje neuspeh. Bolnike je treba spremljati glede znakov in simptomov srčnega popuščanja [glej OKVIRNO OPOZORILO, OPOZORILA IN VARNOSTNI UKREPI ].
V nadzorovanih kliničnih preskušanjih bolnikov s sladkorno boleznijo tipa 2 so poročali o blagih do zmernih edemovih pri bolnikih, ki se zdravijo z zdravilom AVANDIA in so lahko odvisni od odmerka. Bolniki s stalnim edemom so imeli večjo verjetnost neželenih učinkov, povezanih z edemom, če so začeli s kombiniranim zdravljenjem z insulinom in AVANDIA [glejte NEŽELENI REAKCI].
Povečanje telesne mase
Odmerjanje je povezano s povečanjem telesne mase samo z zdravilom AVANDIA in v kombinaciji z drugimi hipoglikemičnimi zdravili (tabela 3). Mehanizem pridobivanja telesne teže je nejasen, vendar verjetno vključuje kombinacijo zadrževanja tekočine in nabiranja maščob.
V izkušnjah po trženju so poročali o nenavadno hitrem povečanju teže in povečanju, ki ga običajno opazimo v kliničnih preskušanjih. Bolnike, pri katerih pride do takšnih zvišanj, je treba oceniti glede nabiranja tekočine in z volumnom povezanih dogodkov, kot sta pretiran edem in kongestivno srčno popuščanje [glejte OKVIRNO OPOZORILO].
Tabela 3 Spremembe teže (kg) od osnovne točke na končni točki med kliničnimi preskušanji
| Monoterapija | Trajanje | Nadzorna skupina | AVANDIA 4 mg Mediana (25., 75.) v odstotkih) |
AVANDIA 8 mg Mediana (25., 75.) v odstotkih) |
|
| Mediana (25., 75.) v odstotkih) | |||||
| 26 tednov | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 tednov | sulfonilsečnina | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombinirana terapija | |||||
| Sulfonilurea | 24-26 tednov | sulfonilsečnina | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformin | 26 tednov | metformin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Inzulin | 26 tednov | inzulina | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonilsečnina + metformin | 26 tednov | sulfonilsečnina + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
V 4- do 6-letnem obdobju monoterapije, primerjalnega preskušanja (ADOPT) pri bolnikih, ki so nedavno diagnosticirali sladkorno bolezen tipa 2, ki prej niso bili zdravljeni z antidiabetičnimi zdravili [glejte Klinični študijs], srednja sprememba teže (25th, 75th v odstotkih od začetne vrednosti pri 4 letih znaša 3,5 kg (0,0, 8,1) za AVANDIA, 2,0 kg (-1,0, 4,8) za gliburid in -2,4 kg (-5,4, 0,5) za metformin.
V 24-tedenski študiji pri pediatričnih bolnikih, starih od 10 do 17 let, ki so se zdravili z zdravilom AVANDIA 4 do 8 mg na dan, je bilo povprečno povečanje telesne mase 2,8 kg (25th, 75th v odstotkih: 0,0, 5,8).
Jetrni učinki
Jetrne encime je treba izmeriti pred začetkom zdravljenja z zdravilom AVANDIA pri vseh bolnikih in občasno po klinični presoji zdravstvenega delavca. Terapije z zdravilom AVANDIA ne smemo začeti pri bolnikih z zvišanimi osnovnimi ravnmi jetrnih encimov (ALT> 2,5X zgornja meja normale). Bolniki z blago povišanimi jetrnimi encimi (vrednost ALT ¤ ‰ 2,5X zgornja meja normale) na izhodišču ali med zdravljenjem z zdravilom AVANDIA je treba oceniti vzrok jetrnih encimov nadmorska višina. Začetek ali nadaljevanje zdravljenja z zdravilom AVANDIA pri bolnikih z blagim zvišanjem jetrnih encimov je treba nadaljevati previdno in vključujejo natančno klinično spremljanje, vključno s spremljanjem jetrnih encimov, da se ugotovi, ali povišanje jetrnih encimov razreši oz poslabšati. Če se kadarkoli ravni ALT pri bolnikih, ki se zdravijo z zdravilom AVANDIA, zvišajo na> 3X zgornjo mejo normalne vrednosti, je treba čim prej preveriti raven jetrnih encimov. Če ravni ALT ostanejo> 3X zgornja meja normalne vrednosti, je treba zdravljenje z zdravilom AVANDIA ukiniti.
Če katerikoli bolnik razvije simptome, ki kažejo na jetrno disfunkcijo, ki lahko vključuje nepojasnjeno slabost, bruhanje, bolečine v trebuhu, utrujenost, anoreksijo in / ali temen urin, je treba preveriti jetrne encime. Odločitev, ali bo bolnika nadaljeval na terapiji z zdravilom AVANDIA, mora temeljiti na klinični presoji do laboratorijskih presoj. Če opazimo zlatenico, je treba zdravljenje z zdravili prekiniti. [Glej NEŽELENI REAKCI.]
Makularni edem
O uporabi makularnega edema so poročali v postmarketinških izkušnjah pri nekaterih bolnikih s sladkorno boleznijo, ki so jemali zdravilo AVANDIA ali drug tiazolidindion. Nekateri bolniki so imeli zamegljen vid ali zmanjšano ostrino vida, nekateri bolniki pa so bili diagnosticirani pri rutinskem oftalmološkem pregledu. Večina bolnikov je imela periferni edem v času, ko je bil postavljen makularni edem. Nekateri bolniki so izboljšali svoj makularni edem po ukinitvi tiazolidindiona. Bolniki s sladkorno boleznijo morajo imeti redne preglede oči pri oftalmologu po standardih oskrbe Ameriškega diabetičnega združenja. Poleg tega je treba vsakega sladkornega bolnika, ki poroča o kakršnih koli vidnih simptomih, nemudoma napotiti k oftalmologu, ne glede na bolnikova zdravila ali druga fizična spoznanja. [Glej NEŽELENI REAKCI.]
Zlomi
Pred kratkim v primerjalni študiji 4- do 6 let (ADOPT) kontrole glikemije z monoterapijo pri bolnikih z zdravili z diagnozo diabetes mellitus tipa 2 so opazili povečano pojavnost zloma kosti pri ženskah, ki so jemale AVANDIA. V obdobju od 4 do 6 let je bila incidenca zloma kosti pri ženskah 9,3% (60/645) za AVANDIA v primerjavi s 3,5% (21/605) za gliburid in 5,1% (30/590) za metformin. Ta povečana incidenca je bila opažena po prvem letu zdravljenja in se je med študijem vztrajala. Večina zlomov pri ženskah, ki so prejele zdravilo AVANDIA, se je zgodila v nadlakti, roki in stopalu. Ta mesta zloma se razlikujejo od tistih, ki so običajno povezana s postmenopavzno osteoporozo (npr. Kolki ali hrbtenica). Pri moških, ki so se zdravili z zdravilom AVANDIA, niso opazili povečanja števila zlomov. Tveganje za zlom je treba upoštevati pri oskrbi bolnikov, zlasti žensk, ki se zdravijo AVANDIA in pozornost namenjena ocenjevanju in vzdrževanju zdravja kosti v skladu z veljavnimi standardi skrb.
Hematološki učinki
Pri odraslih bolnikih, zdravljenih z zdravilom AVANDIA, se je odvisno od odmerka pojavilo znižanje povprečnega hemoglobina in hematokrita [glejte NEŽELENI REAKCI]. Opažene spremembe so lahko povezane s povečanim volumnom plazme, opaženim med zdravljenjem z zdravilom AVANDIA.
Nadzor diabetesa in glukoze v krvi
Bolniki, ki prejemajo zdravilo AVANDIA v kombinaciji z drugimi hipoglikemičnimi zdravili, lahko tvegajo hipoglikemijo, zato bo morda treba zmanjšati odmerek sočasnega zdravila.
Za spremljanje terapevtskega odziva je treba izvajati periodične meritve glukoze v krvi na tešče in HbA1c.
Ovulacija
Terapija z zdravilom AVANDIA, tako kot drugi tiazolidindioni, lahko pri nekaterih ženskah pred menopavzo avulatorno povzroči ovulacijo. Posledično je pri teh bolnikih med jemanjem zdravila AVANDIA lahko večje tveganje za nosečnost [glej Uporaba v specifičnih populacijah]. Zato je treba priporočiti ustrezno kontracepcijo pri ženskah pred menopavzo. Ta možni učinek v kliničnih študijah ni posebej raziskan; zato pogostost tega pojava ni znana.
Čeprav so v predkliničnih študijah opazili hormonsko neravnovesje [glej Neklinična toksikologija], klinični pomen te ugotovitve ni znan. Če pride do nepričakovane menstrualne disfunkcije, je treba pregledati prednosti nadaljevanja zdravljenja z zdravilom AVANDIA.
vrh
Neželeni učinki
Izkušnje s klinično preskušanjem
Odrasli
V kliničnih preskušanjih je zdravilo AVANDIA zdravilo približno 9.900 bolnikov s sladkorno boleznijo tipa 2.
Kratkotrajna preskušanja zdravila AVANDIA kot monoterapija in v kombinaciji z drugimi hipoglikemičnimi zdravili
Incidenca in vrste neželenih učinkov, o katerih so poročali v kratkotrajnih kliničnih preskušanjih zdravila AVANDIA kot monoterapije, so prikazani v preglednici 4.
Tabela 4 Neželeni dogodki (‰ ¥ 5% v kateri koli skupini zdravljenja), ki jih bolniki poročajo v kratkotrajnih * dvojno slepih kliničnih preskušanjih z zdravilom AVANDIA kot mononoterapijo
| Prednostni termin | AVANDIA Monoterapija N = 2,526 % |
Placebo N = 601 % |
Metformin N = 225 % |
Sulfonilureje N = 626 % |
| Okužba zgornjih dihal | 9.9 | 8.7 | 8.9 | 7.3 |
| Poškodba | 7.6 | 4.3 | 7.6 | 6.1 |
| Glavobol | 5.9 | 5.0 | 8.9 | 5.4 |
| Bolečine v hrbtu | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglikemija | 3.9 | 5.7 | 4.4 | 8.1 |
| Utrujenost | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusitis | 3.2 | 4.5 | 5.3 | 3.0 |
| Driska | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglikemija | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Kratkoročna preskušanja so bila od 8 tednov do enega leta. †Vključuje paciente, ki prejemajo gliburid (N = 514), gliklazid (N = 91) ali glipizid (N = 21). |
Na splošno so o vrstah neželenih učinkov, ne glede na vzročnost, poročali ob uporabi zdravila AVANDIA v kombinaciji s sulfonilsečnino ali metforminom sta bili podobni tistim med monoterapijo s AVANDIA.
O pojavih anemije in edemov so se pogosteje poročali pri večjih odmerkih, na splošno pa so bili blagi do zmerni po resnosti in običajno ni bilo treba prekiniti zdravljenja z zdravilom AVANDIA.
V dvojno slepih študijah so poročali o anemiji pri 1,9% bolnikov, ki so prejemali AVANDIA kot monoterapijo, v primerjavi z 0,7% pri placebu, 0,6% pri sulfonilsečnini in 2,2% pri metforminu. Poročila o anemiji so bila večja pri bolnikih, zdravljenih s kombinacijo AVANDIA in metformina (7,1%) in s kombinacijo AVANDIA in sulfonilsečnina plus metformin (6,7%) v primerjavi z monoterapijo z AVANDIA ali v kombinaciji s sulfonilsečnino (2.3%). Nižja raven hemoglobina / hematokrita pri bolnikih, vključenih v klinična preskušanja metformina, je morda v teh študijah prispevala k večji stopnji poročanja o anemiji [glejte NEŽELENI REAKCIJI].
V kliničnih preskušanjih so poročali o edemih pri 4,8% bolnikov, ki so prejemali AVANDIA kot monoterapijo v primerjavi z 1,3% pri placebu, 1,0% pri sulfonilsečnini in 2,2% pri metforminu. Poročanje o edemu je bilo pri kombinacijah AVANDIA 8 mg v kombinacijah sulfonilsečnine višje (12,4%) v primerjavi z drugimi kombinacijami, z izjemo insulina. O edemih so poročali pri 14,7% bolnikov, ki so prejemali zdravilo AVANDIA v preskušanjih kombinacije insulina, v primerjavi s 5,4% samo insulina. Poročila o novem pojavu ali poslabšanju kongestivnega srčnega popuščanja so se pojavila pri stopnjah 1% samo za insulin in 2% (4 mg) in 3% (8 mg) za insulin v kombinaciji z zdravilom AVANDIA [glejte OKVIRNO OPOZORILO in OPOZORILA IN VARNOSTNI UKREPI].
V študijah nadzorovane kombinirane terapije s sulfonilsečnino so poročali o blagih do zmernih hipoglikemičnih simptomih, za katere se zdi, da so odvisni od odmerka. Le malo bolnikov je bilo umaknjenih zaradi hipoglikemije (<1%), nekaj epizod hipoglikemije pa je bilo ocenjeno kot hudo (<1%). Hipoglikemija je bila najpogosteje poročan o neželenih dogodkih v preskušanjih kombiniranih insulinov s fiksnimi odmerki, čeprav se je malo bolnikov umaknilo zaradi hipoglikemije (4 od 408 za AVANDIA plus inzulin in 1 od 203 za insulin sam). Stopnja hipoglikemije, potrjena s koncentracijo glukoze v kapilarni krvi ‰ ¤ mg mg mg 50 mg / dl, je bila 6% samo za inzulin in 12% (4 mg) in 14% (8 mg) za insulin v kombinaciji z zdravilom AVANDIA. [Glej OPOZORILA IN VARNOSTNI UKREPI.]
Dolgoročno preskušanje AVANDIA kot monoterapije
V 4- do 6-letni študiji (ADOPT) so primerjali uporabo AVANDIA (n = 1,456), gliburida (n = 1,441) in metformina (n = 1,454) kot monoterapija pri bolnikih, ki so nedavno diagnosticirali sladkorno bolezen tipa 2, ki prej niso bili zdravljeni z antidiabetikom zdravila. Tabela 5 prikazuje neželene učinke ne glede na vzročnost; stopnje so izražene na 100 izpostavljenosti bolnikov na leto (PY), da se upoštevajo razlike v izpostavljenosti študijskim zdravilom v treh skupinah zdravljenja.
Pri ADOPT so poročali o zlomih pri večjem številu žensk, ki so se zdravile z zdravilom AVANDIA (9,3%, 2,7 / 100 leta bolnikov) v primerjavi z gliburidom (3,5%, 1,3 / 100 bolniških let) ali metforminom (5,1%, 1,5 / 100 leta bolnikov).
Pri večini zlomov pri ženskah, ki so prejemale rosiglitazon, so poročali v nadlakti, roki in stopalu. [Glej OPOZORILA IN VARNOSTNI UKREPI.] Opažena incidenca zlomov pri moških je bila podobna med tremi skupinami zdravljenja.
Tabela 5 Neželeni dogodki na terapiji (¥ Events 5 dogodkov / 100 bolniških let [PY]) v kateri koli skupini za zdravljenje, o kateri so poročali v 4- do 6-letnem kliničnem preskušanju zdravila AVANDIA kot monoterapija (ADOPT)
| AVANDIA N = 1,456 PY = 4.954 |
Glyburide N = 1,441 PY = 4.244 |
Metformin N = 1,454 PY = 4.906 |
|
| Nazofaringitis | 6.3 | 6.9 | 6.6 |
| Bolečine v hrbtu | 5.1 | 4.9 | 5.3 |
| Artralgija | 5.0 | 4.8 | 4.2 |
| Hipertenzija | 4.4 | 6.0 | 6.1 |
| Okužba zgornjih dihal | 4.3 | 5.0 | 4.7 |
| Hipoglikemija | 2.9 | 13.0 | 3.4 |
| Driska | 2.5 | 3.2 | 6.8 |
Otroški
Zdravilo Avandia je bilo ocenjeno glede varnosti v enem samem aktivno kontroliranem preskušanju pediatričnih bolnikov s sladkorno boleznijo tipa 2, v katerih je bilo 99 zdravljenih z zdravilom Avandia, 101 pa z metforminom. Najpogostejši neželeni učinki (> 10%) so bili ne glede na vzročnost za zdravilo Avandia ali metformin glavobol (17% v primerjavi s 14%), slabost (4% v primerjavi z 11%), nazofaringitis (3% v primerjavi z 12%) in driska (1% v primerjavi z 11%) 13%). V tej študiji so v skupini z metforminom poročali o enem primeru diabetične ketoacidoze. Poleg tega so bili v skupini z rosiglitazonom 3 bolniki, ki so imeli FPG v vrednosti 300 mg / dL, 2+ ketonurijo in zvišano anionsko vrzel.
Laboratorijske nepravilnosti
Hematološka
Pri odraslih bolnikih, ki se zdravijo, se je odvisno od odmerka pojavilo znižanje povprečnega hemoglobina in hematokrita z zdravilom Avandia (povprečno znižanje hemoglobina za 1,0 g / dL in kar za 3,3% hematokrit). Spremembe so se pojavile predvsem v prvih 3 mesecih po začetku zdravljenja z zdravilom Avandia ali po povečanju odmerka zdravila Avandia. Časovni potek in obseg zmanjšanja sta bila podobna pri bolnikih, zdravljenih s kombinacijo Avandia in drugih hipoglikemičnih zdravil ali monoterapijo z zdravilom Avandia. Stopnje hemoglobina in hematokrita pred zdravljenjem so bile pri bolnikih v študijah kombiniranega metformina nižje in so morda prispevale k večji stopnji poročanja o slabokrvnosti. V eni sami študiji pri otrocih so poročali o znižanju hemoglobina in hematokrita (povprečno znižanje za 0,29 g / dL in 0,95%). Opisali so tudi majhno znižanje hemoglobina in hematokrita pri otrocih, ki se zdravijo z zdravilom Avandia. Število belih krvnih celic se je tudi nekoliko zmanjšalo pri odraslih bolnikih, ki so se zdravili z zdravilom Avandia. Zmanjšanje hematoloških parametrov je lahko povezano s povečanim volumnom plazme, opaženim pri zdravljenju z zdravilom Avandia.
Lipidi
Po zdravljenju z zdravilom Avandia pri odraslih so opazili spremembe v serumskih lipidih [glej Klinična farmakologija ]. Pri otrocih, zdravljenih z zdravilom Avandia, so poročali o majhnih spremembah serumskih lipidov v 24 tednih.
Ravni transaminaze v serumu
V kliničnih študijah pred odobritvijo 4.598 bolnikov, zdravljenih z Avandia (3.600 bolniških let izpostavljenosti) in pri dolgoročnih 4- do 6-letna študija pri 1.456 bolnikih, zdravljenih z zdravilom Avandia (4.954 bolniških let), ni bilo dokazov o povzročitvi zdravil hepatotoksičnost.
V kontroliranih preskušanjih pred odobritvijo je imelo 0,2% bolnikov, zdravljenih z zdravilom Avandia, zvišanje ALT> 3X zgornje meje normalne vrednosti v primerjavi z 0,2% pri placebu in 0,5% na aktivnih primerjalnikih. Povišanje ALT pri bolnikih, zdravljenih z zdravilom Avandia, je bilo povratno. Hiperbilirubinemijo so ugotovili pri 0,3% bolnikov, zdravljenih z zdravilom Avandia, v primerjavi z 0,9%, zdravljenih s placebom, in 1% pri bolnikih, zdravljenih z aktivnimi primerjalniki. V kliničnih preskušanjih pred odobritvijo ni bilo primerov idiosinkratskih reakcij zdravil, ki bi privedle do odpovedi jeter. [Glej Opozorila in previdnostni ukrepi]
V 4- do 6-letnem preskušanju ADOPT so bili bolniki, zdravljeni z Avandijo (4.954 bolniških let), gliburidom (4.244 izpostavljenosti bolnikov na leta) ali metformin (4.906 bolniških let) je imel kot monoterapija enako stopnjo zvišanja ALT na> 3X zgornjo mejo normale (0,3 na 100 bolniških let) izpostavljenost).
Izkušnje po trženju
Poleg neželenih učinkov, o katerih so poročali v kliničnih preskušanjih, so bili opisani spodaj opisani dogodki med uporabo zdravila Avandia po odobritvi zdravila. Ker se o teh dogodkih prostovoljno poroča iz populacije neznane velikosti, ni mogoče zanesljivo oceniti njihove pogostosti ali vedno vzpostaviti vzročne zveze z izpostavljenostjo drogam.
Pri bolnikih, ki prejemajo zdravljenje s tiazolidindionom, so lahko resni neželeni učinki s smrtnim izidom ali brez njega o povečanju volumna (npr. kongestivno srčno popuščanje, pljučni edem in plevralni izlivi) [glej Opozorilno sporočilo in Opozorila in previdnostni ukrepi].
Obstajajo poročila o prodaji zdravila Avandia za hepatitis, zvišanje jetrnih encimov do 3 ali večkrat več zgornja meja normale in odpoved jeter s smrtnim izidom in brez njega, čeprav vzročnosti še ni bilo ustanovljen.
Redko so poročali o izpuščajih, pruritusu, urtikariji, angioedemu, anafilaktični reakciji in sindromu Stevens-Johnsona.
Prejeta so bila tudi poročila o novem pojavljanju ali poslabšanju diabetičnega makularnega edema z zmanjšano ostrino vida [glej Opozorila in previdnostni ukrepi].
vrh
Interakcije z zdravili
Zaviralci in induktorji CYP2C8
Zaviralec CYP2C8 (npr. Gemfibrozil) lahko poveča AUC rosiglitazona, induktor CYP2C8 (npr. Rifampin) pa lahko zmanjša AUC rosiglitazona. Če se med zdravljenjem z rosiglitazonom zavira ali ustavi zaviralec ali induktor CYP2C8, bodo morda potrebne spremembe pri zdravljenju sladkorne bolezni na podlagi kliničnega odziva. [Glej KLINIČNA FARMAKOLOGIJA.]
vrh
Uporaba v specifičnih populacijah
Nosečnost
Nosečnost kategorija C.
Vse nosečnosti so v ozadju nevarne za prirojene okvare, izgubo ali druge škodljive izide, ne glede na izpostavljenost zdravilu. To tveganje v ozadju se poveča pri nosečnostih, zapletenih zaradi hiperglikemije, in se lahko zmanjša z dobrim metaboličnim nadzorom. Za bolnike s sladkorno boleznijo ali anamnezo gestacijske sladkorne bolezni je pomembno, da ohranijo dobro presnovo pred spočetjem in v celotni nosečnosti. Pozorno spremljanje nadzora glukoze je pri takšnih bolnikih nujno. Večina strokovnjakov priporoča, da se med nosečnostjo uporablja monoterapija z insulinom, da se raven glukoze v krvi čim bolj približa normalni.
Človeški podatki: Poročalo se je, da Rosiglitazon prečka človeško posteljico in se lahko zazna v tkivu ploda. Klinični pomen teh ugotovitev ni znan. Ustreznih in dobro nadzorovanih študij pri nosečnicah ni. Zdravila AVANDIA ne smete uporabljati med nosečnostjo.
Študije na živalih: Pri podganah ni bilo vpliva na implantacijo ali na zarodek z zdravljenjem z rosiglitazonom, vendar zdravljenje med srednjo pozno gestacijo je bilo povezano s smrtjo ploda in upočasnitvijo rasti pri podganah in zajcih. Pri odmerkih do 3 mg / kg pri podganah in 100 mg / kg pri kuncih (približno 20-kratnega in 75-kratnega AUC za človeka pri največjem priporočenem dnevnem odmerku pri ljudeh) niso opazili teratogenosti. Rosiglitazon je povzročil patologijo posteljice pri podganah (3 mg / kg / dan). Zdravljenje podgan med nosečnostjo z laktacijo je zmanjšalo velikost stelje, neonatalno sposobnost in poporodno rast, z upočasnitvijo rasti pa po puberteti. Za učinke na posteljico, zarodek / plod in potomce je bil odmerek brez učinka 0,2 mg / kg / dan pri podganah in 15 mg / kg / dan pri kuncih. Te ravni brez učinka so približno 4-krat večje od AUC pri ljudeh pri največjem priporočenem dnevnem odmerku pri ljudeh. Rosiglitazon je zmanjšal število vsadkov maternice in živih potomcev, ko so bile mladoletne podgane obdelane pri 40 mg / kg / dan od 27. dneva starosti do spolne zrelosti (približno 68-kratna AUC pri ljudeh na največji priporočeni dan) odmerek). Raven brez učinka je bila 2 mg / kg / dan (približno 4-kratna AUC pri človeku pri največjem priporočenem dnevnem odmerku). Na prenatalno preživetje ali rast ni vplivalo.
Delo in dostava
Vpliv rosiglitazona na porod in porod pri ljudeh ni znan.
Doječe matere
Material, povezan z drogami, je bil odkrit v mleku pri doječih podganah. Ni znano, ali se AVANDIA izloča v materino mleko. Ker se v materino mleko izloča veliko zdravil, zdravila AVANDIA ne smejo dajati doječi ženski.
Uporaba pri otrocih
Otroci z diabetesom mellitusom tipa 2, starim od 10 do 17 let in z izhodiščnim povprečnim indeksom telesne mase (BMI), po placebu, vključno s svetovanjem o dieti, znašajo 33 kg / m so bili naključno razporejeni z zdravljenjem z 2 mg dvakrat na dan AVANDIA (n = 99) ali 500 mg dvakrat na dan metformina (n = 101) v 24-tedenski, dvojno slepi kliniki sojenje. Kot je bilo pričakovano, se je FPG zmanjšal pri bolnikih, ki so prejemali zdravljenje sladkorne bolezni (n = 104) in se povečal pri bolnikih, ki so med zdravljenjem umaknili predhodno zdravljenje (običajno metformin) (n = 90). Po najmanj 8 tednih zdravljenja je 49% bolnikov, ki so se zdravili z zdravilom AVANDIA, in 55% bolnikov, zdravljenih z metforminom, odmerek podvojilo, če je FPG> 126 mg / dL. V celotni populaciji z namenom zdravljenja je bila v 24. tednu povprečna sprememba izhodiščne vrednosti HbA1c -0,14% z zdravilom AVANDIA in -0,49% z metforminom. V tej študiji ni bilo dovolj bolnikov, da bi lahko statistično ugotovili, ali so ti
opaženi povprečni učinki zdravljenja so bili podobni ali različni. Učinki zdravljenja so bili različni pri bolnikih, ki so se zdravili z antidiabetiki in pri bolnikih, ki so bili predhodno zdravljeni z antidiabetičnimi zdravili (tabela 6).
Tabela 6. 24. teden Sprememba FPG in HbA1c od začetne zadnje opazovanja naprej pri otrocih z osnovno črto HbA1c> 6,5%
| Naïve pacienti | Predhodno zdravljeni bolniki | |||
|
Metformin N = 40 |
Rosiglitazon N = 45 |
Metformin N = 43 |
Rosiglitazon N = 32 |
|
| FPG (mg / dL) | ||||
| Izhodišče (povprečje) | 170 | 165 | 221 | 205 |
| Sprememba od osnovne (povprečna) | -21 | -11 | -33 | -5 |
| Prilagojena razlika v zdravljenju * (rosiglitazon-metformin) â € (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Izhodišče (povprečje) | 8.3 | 8.2 | 8.8 | 8.5 |
| Sprememba od osnovne (povprečna) | -0.7 | -0.5 | -0.4 | 0.1 |
| Prilagojena razlika v zdravljenju * (rosiglitazon-metformin) â € (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 63% | 52% | 54% | 31% |
|
* Sprememba od osnovne vrednosti je najmanjši kvadrat, pomeni prilagajanje za izhodiščno vrednost HbA1c, spol in regijo. †Pozitivne vrednosti za razliko favorizirajo metformin. |
Razlike v zdravljenju so bile odvisne od izhodiščnega indeksa telesne mase ali teže, tako da so bili učinki zdravila AVANDIA in metformina med težjimi bolniki videti bolj primerljivi. Srednje povečanje telesne mase je bilo 2,8 kg z rosiglitazonom in 0,2 kg z metforminom [glej OPOZORILA IN VARNOSTNI UKREPI]. Petinštirideset odstotkov bolnikov, ki so se zdravili z rosiglitazonom, in 32% bolnikov, ki so se zdravili z metforminom, je pridobil 2 kg in 33% bolnikov, ki so se zdravili z rosiglitazonom, in 7% bolnikov, ki so se zdravili z metforminom, pridobili 5 kg na študij.
Neželeni učinki, opaženi v tej študiji, so opisani v Neželeni učinki).
Slika 3 Povprečni čas HbA1c v 24-tedenski študiji AVANDIA in metformina pri pediatričnih bolnikih - Podgrupa Drug-NaÃveve
Geriatrična uporaba
Rezultati populacijske farmakokinetične analize so pokazali, da starost pomembno ne vpliva na farmakokinetiko rosiglitazona [glej KLINIČNA FARMAKOLOGIJA]. Zato pri starejših ni treba prilagoditi odmerjanja. V nadzorovanih kliničnih preskušanjih niso opazili splošnih razlik v varnosti in učinkovitosti med starejšimi (‰ ¥ 65 let) in mlajšimi (<65 let) bolniki.
vrh
Preveliko odmerjanje
Glede prevelikega odmerjanja pri ljudeh je na voljo omejenih podatkov. V kliničnih študijah pri prostovoljcih so zdravilo AVANDIA dajali v enkratnih peroralnih odmerkih do 20 mg in so ga dobro prenašali. V primeru prevelikega odmerjanja je treba začeti ustrezno podporno zdravljenje, kot narekuje bolnikov klinični status.
vrh
Opis
AVANDIA (rosiglitazon maleat) je peroralno antidiabetično sredstvo, ki deluje predvsem s povečanjem občutljivosti na inzulin. AVANDIA izboljšuje nadzor glikemije in hkrati znižuje raven insulina v obtoku.
Rosiglitazon maleat ni kemično ali funkcionalno povezan s sulfonilsečnino, biguanidi ali zaviralci alfa-glukozidaze.
Kemično je rosiglitazon maleat (±) -5 - [[4- [2- (metil-2-piridinilamino) etoksi] fenil] metil] -2,4-tiazolidindion, (Z) -2-butendioat (1: 1) z molekulsko maso 473,52 (357,44 prosta baza). Molekula ima eno samo kiralno središče in je prisotna kot racemat. Zaradi hitre medsebojne pretvorbe so enantiomeri funkcionalno nerazločljivi. Strukturna formula rosiglitazon maleata je:
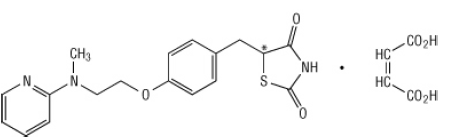
Molekularna formula je C18H19N3O3S-C4H4O4. Rosiglitazon maleat je bela do skoraj bela trdna snov s tališčem od 122 do 123 ° C. Vrednosti pKa rosiglitazon maleuta so 6,8 in 6,1. Je lahko topen v etanolu in a puferirana vodna raztopina s pH 2,3; topnost se zmanjšuje s povečanjem pH v fiziološkem domet.
Vsaka peterokotna filmsko obložena tableta TILTAB vsebuje rosiglitazon maleat, enakovreden rosiglitazonu, 2 mg, 4 mg ali 8 mg, za peroralno dajanje. Neaktivne sestavine so: hipromeloza 2910, laktoza monohidrat, magnezijev stearat, mikrokristalna celuloza, polietilen glikol 3000, natrijev škrobni glikolat, titanov dioksid, triacetin in 1 ali več naslednjega: sintetični rdeči in rumeni železov oksid in talk.
vrh
Klinična farmakologija
Mehanizem delovanja
Rosiglitazon, ki je član antidiabetikov v tiazolidindionu, izboljša nadzor glikemije z izboljšanjem občutljivosti na inzulin. Rosiglitazon je zelo selektiven in močan agonist za receptor-gama (PPAR3), ki se aktivira s proliferatorjem s proliferatorjem. Pri ljudeh se PPAR receptorji nahajajo v ključnih ciljnih tkivih za delovanje insulina, kot so maščobno tkivo, skeletne mišice in jetra. Aktivacija nuklearnih receptorjev PPARγ ureja transkripcijo genov, ki so odzivni na inzulin, ki sodelujejo pri nadzoru proizvodnje, prevoza in uporabe glukoze. Poleg tega geni, odzivni na PPARγ, sodelujejo tudi pri uravnavanju presnove maščobnih kislin.
Inzulinska odpornost je običajna značilnost, ki označuje patogenezo sladkorne bolezni tipa 2. Antidiabetična aktivnost rosiglitazona je bila dokazana na živalskih modelih diabetesa tipa 2 pri ki sta hiperglikemija in / ali oslabljena glukozna toleranca posledica odpornosti na inzulin pri tarči tkiva. Rosiglitazon zmanjša koncentracijo glukoze v krvi in zmanjša hiperinzulinemijo pri ob / ob debeli miški, db / db diabetični miški in fa / fa maščobni podgana Zucker.
V živalskih modelih so pokazali, da je antidiabetično delovanje rosiglitazona posredovano s povečano občutljivostjo na delovanje insulina v jetrih, mišicah in maščobnih tkivih. Farmakološke študije na živalskih modelih kažejo, da rosiglitazon zavira jetrno glukoneogenezo. Izražanje insulinsko reguliranega prenašalca glukoze GLUT-4 se je povečalo v maščobnem tkivu. Rosiglitazon ni povzročil hipoglikemije pri živalskih modelih sladkorne bolezni tipa 2 in / ali oslabljene tolerance glukoze.
Farmakodinamika
Bolniki z lipidnimi nepravilnostmi niso bili izključeni iz kliničnih preskušanj zdravila AVANDIA.
V vseh 26-tedenskih nadzorovanih preskušanjih je bilo zdravilo AVANDIA kot monoterapija povezano s povečanjem skupnega holesterola, LDL in HDL ter zmanjšanjem prostih maščobnih kislin. Te spremembe so se statistično značilno razlikovale od kontrol nad placebom ali gliburidom (preglednica 7).
Povišanje LDL se je pojavilo predvsem v prvih 1 do 2 mesecih zdravljenja z zdravilom AVANDIA in ravni LDL so bile med vsemi preskušanji povišane nad izhodiščno vrednostjo. V nasprotju s tem je HDL sčasoma še naraščal. Kot rezultat, je razmerje LDL / HDL doseglo vrh po 2 mesecih terapije in se nato sčasoma zmanjšalo. Zaradi časovne narave sprememb lipidov je 52-tedenska raziskava z nadzorom gliburida najpomembnejša za oceno dolgoročnih učinkov lipidov. Na začetku, 26. in 52. teden, so bila povprečna razmerja LDL / HDL za AVANDIA 4 mg dvakrat na dan 3,1, 3,2 in 3,0. Ustrezne vrednosti gliburida so bile 3,2, 3,1 in 2,9. Razlike v spremembi glede na izhodišče med AVANDIA in gliburidom v 52. tednu so bile statistično pomembne.
Vzorec sprememb LDL in HDL po zdravljenju z zdravilom AVANDIA v kombinaciji z drugimi hipoglikemičnimi zdravili je bil na splošno podoben tistim, ki so jih videli pri AVANDIA pri monoterapiji.
Spremembe trigliceridov med terapijo z zdravilom AVANDIA so bile različne in se na splošno niso statistično razlikovale od kontrol nad placebom ali gliburidom.
Tabela 7 Povzetek povprečnih sprememb lipidov v 26-tedenskih placebo nadzorovanih in 52-tedenskih študijah monoterapije z gliburidom
| 26. teden s placebom nadzorovanih študij | 26. in 52. teden študija, ki ga nadzira glyburide | ||||||
| Placebo | AVANDIA | Titracija gliburida | AVANDIA 8 mg | ||||
| 4 mg dnevno * | 8 mg dnevno * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Proste maščobne kisline | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Izhodiščna vrednost (povprečje)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Sprememba od osnovne (povprečna) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Izhodiščna vrednost (povprečje)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Sprememba od osnovne (povprečna) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Izhodiščna vrednost (povprečje)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Sprememba od osnovne (povprečna) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Skupine odmerjanja enkrat na dan in dvakrat na dan so bile kombinirane. |
Farmakokinetika
Največja plazemska koncentracija (Cmax) in površina pod krivuljo (AUC) rosiglitazona se povečata sorazmerno odmerku v območju terapevtskega odmerka (tabela 8). Razpolovni čas izločanja je 3 do 4 ure in ni odvisen od odmerka.
Tabela 8 Srednji (SD) farmakokinetični parametri za roziglitazon po posameznih peroralnih odmerkih (N = 32)
| Parameter | 1 mg na tešče | 2 mg na tešče | 8 mg na tešče | 8 mg Fed |
| AUC0-inf [ng-hr / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Polovično življenje [h] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / h] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = ustni odmik. |
Absorpcija
Absolutna biološka uporabnost rosiglitazona je 99%. Najvišjo plazemsko koncentracijo opazimo približno eno uro po odmerjanju. Uporaba rosiglitazona s hrano ni povzročila spremembe celotne izpostavljenosti (AUC), vendar je prišlo do približno 28% znižanja Cmax in zamude Tmax (1,75 ure). Te spremembe verjetno niso klinično pomembne; zato lahko zdravilo AVANDIA dajemo s hrano ali brez nje.
Distribucija
Na podlagi populacijske farmakokinetične analize je povprečni (CV%) peroralni volumen porazdelitve (Vss / F) rosiglitazona približno 17,6 (30%) litrov. Rosiglitazon se približno 99,8% veže na plazemske beljakovine, predvsem na albumine.
Presnova
Rosiglitazon se intenzivno presnavlja, pri čemer se v urinu ne izloči nespremenjenega zdravila. Glavni presnovi sta bili N-demetilacija in hidroksilacija, sledila je konjugacija s sulfatom in glukuronsko kislino. Vsi cirkulirajoči presnovki so bistveno manj močni od matičnih in zato ni pričakovati, da bodo prispevali k insulitibilni aktivnosti rosiglitazona.
Podatki in vitro kažejo, da se rosiglitazon pretežno presnavlja z izoencimom 2C8 citokroma P450 (CYP), pri čemer CYP2C9 prispeva kot manjši pot.
Izločanje
Po peroralni ali intravenski uporabi [14C] rosiglitazon maleata se je približno 64% in 23% odmerka izločilo z urinom oziroma v blatu. Razpolovni čas v plazmi materiala, povezanega s [14C], je znašal od 103 do 158 ur.
Populacijska farmakokinetika pri bolnikih s sladkorno boleznijo tipa 2
Populacijske farmakokinetične analize iz treh velikih kliničnih preskušanj, vključno s 642 moškimi in 405 ženskami s sladkorno boleznijo tipa 2 (stari 35 let do 80 let) so pokazali, da starost, rasa, kajenje ali alkohol na farmakokinetiko rosiglitazona ne vplivajo poraba. Pokazalo se je, da se s povečanjem telesne teže povečujeta tako peroralni očistek (CL / F) kot tudi peroralni volumen porazdelitve v stanju dinamičnega ravnovesja (Vss / F). V razponu teže, ugotovljenem v teh analizah (od 50 do 150 kg), se je razpon predvidenih vrednosti CL / F in Vss / F spreminjal za <1,7-krat in <2,3-krat več.
Poleg tega se je pokazalo, da na rosiglitazon CL / F vplivata teža in spol, saj je pri ženskah bolnik nižji (približno 15%).
Posebne populacije
Geriatrična
Rezultati populacijske farmakokinetične analize (n = 716 <65 let; n = 331 ‰ ¥ 65 let) je pokazalo, da starost pomembno ne vpliva na farmakokinetiko rosiglitazona.
Spol
Rezultati analize populacijske farmakokinetike so pokazali, da je povprečni peroralni očistek rosiglitazona v žensk (n = 405) je bilo približno 6% nižje v primerjavi z moškimi iste telesne teže (n = 642).
Kot monoterapija in v kombinaciji z metforminom je zdravilo AVANDIA izboljšalo nadzor glikemije pri moških in ženskah. V študijah kombiniranega metformina je bila dokazana učinkovitost brez razlike med spoloma v glikemičnem odzivu.
V študijah monoterapije so opazili večji terapevtski odziv pri ženskah; vendar so bile pri bolj debelih bolnikih razlike med spoloma manj očitne. Pri določenem indeksu telesne mase (BMI) imajo ženske večje maščobne mase kot moški. Ker se molekularna tarča PPARγ izraža v maščobnih tkivih, lahko ta razlikovalna značilnost vsaj deloma pomeni večji odziv na AVANDIA pri ženskah. Ker je treba terapijo individualizirati, prilagoditve odmerka niso potrebne samo glede na spol.
Okvara jeter
Nepovezani peroralni očistek rosiglitazona je bil znatno nižji pri bolnikih z zmerno do hudo jetrno boleznijo (Child-Pugh razred B / C) v primerjavi z zdravimi osebami. Posledično sta bila povečana Cmax in AUC0-inf 2-krat oz. 3-krat. Razpolovni čas izločanja rosiglitazona je bil pri bolnikih z jetrno boleznijo približno 2 uri daljši v primerjavi z zdravimi osebami.
Terapije z zdravilom AVANDIA se ne sme začeti, če ima bolnik klinične dokaze, da so aktivni jetrna bolezen ali zvišane ravni transaminaze v serumu (ALT> 2,5X zgornja meja normalne vrednosti) [glej OPOZORILA IN VARNOSTNI UKREPI].
Otroški
Farmakokinetični parametri rosiglitazona pri otrocih so bili določeni z uporabo populacijske farmakokinetične analize z redkimi podatki iz 96 pediatričnih bolnikov v enem samem otroškem kliničnem preskušanju, vključno s 33 moškimi in 63 ženskami v starosti od 10 do 17 let (uteži od 35 do 178,3 kg). Povprečna populacija CL / F in V / F rosiglitazona sta bila 3,15 L / h oziroma 13,5 L. Te ocene CL / F in V / F so bile skladne s tipičnimi ocenami parametrov iz predhodne analize odrasle populacije.
Ledvična okvara
Klinično pomembnih razlik v farmakokinetiki rosiglitazona ni pri bolnikih z blago hudo okvaro ledvic ali pri bolnikih, odvisnih od hemodialize, v primerjavi s preiskovanci z normalnim delovanjem ledvic funkcijo. Zato pri takih bolnikih, ki prejemajo AVANDIA, odmerka ni treba prilagoditi. Ker je metformin kontraindiciran pri bolnikih z ledvično okvaro, je sočasna uporaba metformina z zdravilom AVANDIA pri teh bolnikih kontraindicirana.
Dirka
Rezultati populacijske farmakokinetične analize, vključno z osebami kavkaškega, črnega in drugega etničnega izvora, kažejo, da rasa nima vpliva na farmakokinetiko rosiglitazona.
Interakcije med drogami
Zdravila, ki zavirajo, povzročajo ali presnavljajo citokrom P450
Študije presnove zdravil in vitro kažejo, da rosiglitazon pri klinično pomembnih koncentracijah ne zavira nobenega od glavnih encimov P450. Podatki in vitro kažejo, da se rosiglitazon pretežno presnavlja s CYP2C8 in v manjši meri 2C9. Za AVANDIA (4 mg dvakrat na dan) ni bilo klinično pomembnega učinka na farmakokinetiko nifedipin in peroralni kontraceptivi (etinilestradiol in noretindron), ki se pretežno presnavljajo z CYP3A4
Gemfibrozil
Sočasno jemanje gemfibrozila (600 mg dvakrat na dan), zaviralca CYP2C8 in rosiglitazona (4 mg enkrat dnevno) 7 dni povečala AUC rosiglitazona za 127% v primerjavi z uporabo rosiglitazona (4 mg enkrat na dan) sam. Glede na potencial neželenih učinkov, povezanih z odmerjanjem rosiglitazona, bo ob uvedbi gemfibrozila morda treba zmanjšati odmerek rosiglitazona [glejte INTERAKCIJE DROGA].
Rifampin
Po poročanju o dajanju rifampina (600 mg enkrat na dan), induktorju CYP2C8, 6 dni zniža AUC rosiglitazona za 66% v primerjavi z uporabo samega rosiglitazona (8 mg) [glejte INTERAKCIJE DROGA].4
Glyburide
AVANDIA (2 mg dvakrat na dan), jemljena sočasno z gliburidom (3,75 do 10 mg / dan) 7 dni, se ni spremenila povprečne 24-urne koncentracije glukoze v plazmi pri bolnikih s sladkorno boleznijo, stabiliziranih na gliburidu terapija. Ponavljajoči odmerki zdravila AVANDIA (8 mg enkrat na dan) 8 dni pri zdravih odraslih preiskovancih belcev so povzročili znižanje AUC in Cmax gliburida za približno 30%. Pri japonskih osebah sta se AUC in Cmax gliburida rahlo povečala po sočasni uporabi zdravila AVANDIA.
Glimepirid
Enkratni peroralni odmerki glimepirida pri 14 zdravih odraslih osebah niso klinično pomembno vplivali na farmakokinetiko zdravila AVANDIA v stanju dinamičnega ravnovesja. Ni klinično pomembnih zmanjšanj AUC in C glimepiridamaks opazili so po večkratnih odmerkih zdravila AVANDIA (8 mg enkrat na dan) 8 dni pri zdravih odraslih osebah.
Metformin
Sočasna uporaba zdravila AVANDIA (2 mg dvakrat na dan) in metformina (500 mg dvakrat na dan) pri zdravih prostovoljci 4 dni niso vplivali na farmakokinetiko v stanju dinamičnega ravnovesja bodisi metformina bodisi rosiglitazon.
Acarbose
Sočasna uporaba akarboze (100 mg trikrat na dan) pri zdravih prostovoljcih ni klinično pomembno vplivala na farmakokinetiko posameznega peroralnega odmerka zdravila AVANDIA.
Digoksin
Ponavljajoče peroralno odmerjanje zdravila AVANDIA (8 mg enkrat na dan) 14 dni pri zdravih prostovoljcih ni spremenilo farmakokinetike digoksina v stanju dinamičnega ravnovesja (0,375 mg enkrat na dan).
Warfarin
Ponavljajoče odmerjanje zdravila AVANDIA ni imelo klinično pomembnega učinka na farmakokinetiko varfarinskih enantiomerov v stanju dinamičnega ravnovesja.
Etanol
Enkratna uporaba zmerne količine alkohola ni povečala tveganja za akutno hipoglikemijo pri bolnikih s sladkorno boleznijo tipa 2, zdravljenih z zdravilom AVANDIA.
Ranitidin
Predobravnava z ranitidinom (150 mg dvakrat na dan 4 dni) pri zdravih prostovoljcih ni spremenila farmakokinetike niti peroralnih niti intravenskih odmerkov rosiglitazona.
Ti rezultati kažejo, da se absorpcija peroralnega rosiglitazona ne spremeni v pogojih, ki jih spremlja povečanje pH prebavil.
vrh
Neklinična toksikologija
Kancerogeneza, mutageneza, oslabitev plodnosti
Rakotvorna snov:
Dveletna študija rakotvornosti je bila izvedena na miših Charles River CD-1 v odmerkih 0,4, 1,5 in 6 mg / kg / dan v prehrana (najvišji odmerek, ki ustreza približno 12-kratni AUC pri človeku, pri največjem priporočenem človeku na dan odmerek). Podgane Sprague-Dawley so odmerjale 2 leti s peroralnim odmerjanjem v odmerkih 0,05, 0,3 in 2 mg / kg / dan (najvišji ekvivalent odmerka) do približno 10 in 20-kratne AUC za človeka pri najvišjem priporočenem dnevnem odmerku za človeka in samice podgan, oz.).
Rosiglitazon pri miših ni bil rakotvoren. Povečal se je pogostnost hiperplazije adipozne hipoplazije pri miših pri odmerkih 1,5 mg / kg / dan (približno 2-krat večji od AUC pri ljudeh pri največjem priporočenem dnevnem odmerku pri človeku). Pri podganah se je znatno povečala pojavnost benignih tumorjev maščobnega tkiva (lipomi) pri odmerkih 0,3 mg / kg / dan (približno 2-kratni AUC pri človeku pri največjem priporočenem dnevnem odmerku pri ljudeh). Te proliferativne spremembe pri obeh vrstah so upoštevane zaradi vztrajne farmakološke prekomerne stimulacije maščobnega tkiva.
Mutageneza:
In vitro bakterijski testi za gensko mutacijo roiglitazon niso bili mutageni ali klastogeni, in vitro kromosomski aberacijski test na človeških limfocitih, test in mikrožiklemične mišične snovi in vivo in UDS podgana in vivo / in vitro esej. V preskusu in vitro na mišjem limfomu se je pojavilo majhno (približno dvakratno) prisotnost presnovne aktivacije.
Oslabitev plodnosti:
Rosiglitazon ni vplival na parjenje ali plodnost samcev podgan, ki so prejemale do 40 mg / kg / dan (približno 116-krat večji od AUC pri človeku pri največjem priporočenem dnevnem odmerku pri človeku). Rosiglitazon je spremenil grozljivo cikličnost (2 mg / kg / dan) in zmanjšal plodnost (40 mg / kg / dan) samic podgan v povezavi z nižjimi ravni progesterona in estradiola v plazmi (približno 20 in 200-kratna AUC pri ljudeh pri največjem priporočenem dnevnem odmerku pri ljudeh, oz.). Pri 0,2 mg / kg / dan (približno 3-kratni AUC pri človeku pri največjem priporočenem dnevnem odmerku pri človeku) niso opazili takšnih učinkov. Pri mladoletnih podganah, ki so odmerjale od 27. dneva starosti do spolne zrelosti (do 40 mg / kg / dan), ni bilo vpliva na reproduktivno sposobnost moških, o stranski cikličnosti, parjenju ali pojavnosti nosečnosti pri ženskah (približno 68-krat večji od AUC pri ljudeh pri največjem priporočenem človeškem dnevu odmerek). Pri opicah rosiglitazon (0,6 in 4,6 mg / kg / dan; približno 3-krat 15-kratni AUC pri človeškem najvišjem priporočenem dnevnem odmerku pri človeku je zmanjšal porast folikularne faze v serumskem estradiolu s posledičnim zmanjšanjem porasta luteinizirajočega hormona, znižanjem ravni progesterona v lutealni fazi in amenoreja Mehanizem teh učinkov je neposredno zaviranje steroidogeneze jajčnikov.
Toksikologija živali
Povečanje srčne teže pri miših (3 mg / kg / dan), podganah (5 mg / kg / dan) in psih (2 mg / kg / dan) z rosiglitazonom zdravljenja (približno 5, 22 in 2-kratna AUC pri ljudeh pri največjem priporočenem dnevnem odmerku pri ljudeh). Učinki pri mladoletnih podganah so bili skladni z učinki pri odraslih. Morfometrična meritev je pokazala, da je v tkivih srčnega prekata prišlo do hipertrofije, kar je lahko posledica povečanega srčnega dela kot posledice razširitve volumna v plazmi.
vrh
Klinične študije
Monoterapija
V kliničnih študijah je zdravljenje z zdravilom AVANDIA povzročilo izboljšanje nadzora glikemije, merjeno s FPG in HbA1c, ob hkratnem zmanjšanju insulina in C-peptida. Znižala sta se tudi postprandialna glukoza in inzulin. To je skladno z mehanizmom delovanja zdravila AVANDIA kot občutljivega na inzulin.
Največji priporočeni dnevni odmerek je 8 mg. Študije, ki temeljijo na odmerjanju, kažejo, da s skupnim dnevnim odmerkom 12 mg ni bilo nobene dodatne koristi.
Kratkoročne klinične študije: Skupaj 2.315 bolnikov s sladkorno boleznijo tipa 2, ki so se prej zdravili s samo dieto ali protidiabetičnimi zdravili, so zdravili z zdravilom AVANDIA kot monoterapijo pri 6 dvojno slepih študije, ki so vključevale dve 26-tedensko s placebom nadzorovane študije, eno 52-tedensko nadzorovano gliburide in 3 placebo nadzorovane študije v odmerku od 8 do 12 tednov. Prejšnja zdravila proti diabetiki so bila umaknjena in bolniki so pred randomizacijo vstopili v obdobje 2 do 4 tednov placeba.
Dva 26-tedenska dvojno slepa preskušanja s placebom nadzorovana pri bolnikih s sladkorno boleznijo tipa 2 (n = 1.401) z neustrezno glikemijo kontrola (povprečna izhodiščna vrednost FPG približno 228 mg / dl [101 do 425 mg / dL] in povprečna izhodiščna vrednost HbA1c 8,9% [5,2% do 16,2%]), izvedeno. Zdravljenje z zdravilom AVANDIA je prineslo statistično značilne izboljšave FPG in HbA1c v primerjavi z izhodiščem in glede na placebo. Podatki ene od teh raziskav so povzeti v tabeli 9.
Tabela 9: Glikemični parametri v 26-tedenski preskušanju s placebom
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg enkrat na dan N = 180 |
2 mg dvakrat na dan N = 186 |
8 mg enkrat na dan N = 181 |
4 mg dvakrat na dan N = 187 |
||
| FPG (mg / dL) | |||||
| Izhodišče (povprečje) | 225 | 229 | 225 | 228 | 228 |
| Sprememba od osnovne (povprečna) | 8 | -25 | -35 | -42 | -55 |
| Razlika od placeba (prilagojena srednja vrednost) | - | -31* | -43* | -49* | -62* |
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Izhodišče (povprečje) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Sprememba od osnovne (povprečna) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Razlika od placeba (prilagojena srednja vrednost) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 v primerjavi s placebom. |
Kadar ga dajemo v istem skupnem dnevnem odmerku, je bila AVANDIA na splošno bolj učinkovita pri zmanjševanju FPG in HbA1c, če ga dajemo v odmerkih dvakrat na dan v primerjavi z odmerki enkrat na dan. Vendar pa za HbA1c razlika med odmerkom 4 mg enkrat na dan in 2 mg dvakrat na dan ni bila statistično značilna.
Dolgotrajne klinične študije
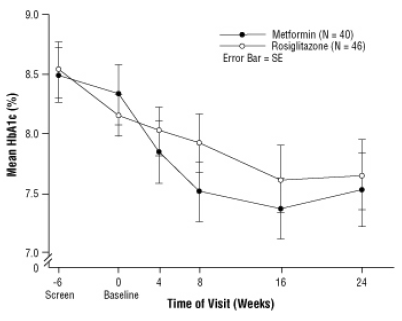
Dolgotrajno vzdrževanje učinka je bilo ocenjeno v 52-tedenskem dvojno slepem preskušanju z nadzorom gliburida pri bolnikih s sladkorno boleznijo tipa 2. Bolniki so bili 52 tednov randomizirani na zdravljenje z zdravilom AVANDIA 2 mg dvakrat na dan (N = 195) ali AVANDIA 4 mg dvakrat na dan (N = 189) ali z gliburidom (N = 202). Bolniki, ki so prejemali gliburid, so dobili začetni odmerek 2,5 mg / dan ali 5,0 mg / dan. Odmerek smo nato titrirali v korakih po 2,5 mg / dan v naslednjih 12 tednih do največjega odmerka 15,0 mg / dan, da bi optimizirali nadzor glikemije. Nato je bil odmerek gliburida nespremenjen.
Mediani titrirani odmerek gliburida je bil 7,5 mg. Vsa zdravljenja so privedla do statistično pomembnega izboljšanja nadzora glikemije v primerjavi z izhodiščem (sliki 4 in slika 5). Konec 52. tedna je bilo znižanje izhodiščne vrednosti za FPG in HbA1c -40,8 mg / dL in -0,53% z 4 mg AVANDIA dvakrat na dan; -25,4 mg / dL in -0,27% z zdravilom AVANDIA 2 mg dvakrat na dan; in -30,0 mg / dL in -0,72% z gliburidom. Za HbA1c razlika med 4 mg AVANDIA dvakrat na dan in gliburidom v 52. tednu ni bila statistično značilna. Začetni padec FPG z gliburidom je bil večji kot pri AVANDIA; vendar je bil ta učinek sčasoma manj trpežen.
Izboljšanje kontrole glikemije, opaženo pri uporabi zdravila AVANDIA 4 mg dvakrat na dan v 26. tednu, se je ohranilo v 52. tednu študije.
Slika 4 Povprečni FPG sčasoma v 52-tedenski študiji, nadzorovani z gliburidi

Slika 5 Povprečni čas HbA1c v 52-tedenski študiji, nadzorovani z gliburidi
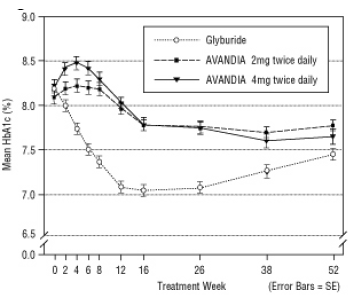
O hipoglikemiji so poročali pri 12,1% bolnikov, zdravljenih z gliburidom, v primerjavi z 0,5% (2 mg dvakrat na dan) in 1,6% (4 mg dvakrat na dan) bolnikov, ki so se zdravili z zdravilom AVANDIA. Izboljšanje nadzora glikemije je bilo povezano s povprečnim povečanjem teže 1,75 kg in 2,95 kg za bolniki, zdravljeni z 2 mg in 4 mg dvakrat na dan AVANDIA, v primerjavi z 1,9 kg pri zdravljenju z gliburidom bolniki. Pri bolnikih, zdravljenih z zdravilom AVANDIA, so bili C-peptid, inzulin, pro-inzulin in pro-insulinski cepivi v primerjavi s povečanjem zdravljenja z gliburidom znatno zmanjšala odmerek bolniki.
Preskus napredovanja sladkorne bolezni (ADOPT) je bilo večcentrično, dvojno slepo, nadzorovano preskušanje (N = 4,351), opravljeno v 4 do 6 letih za primerjavo varnosti in učinkovitosti monoterapije z AVANDIA, metforminom in gliburidom pri bolnikih, ki jim je nedavno diagnosticiran diabetes mellitus tipa 2 (‰ ¤ 3 leta), ki niso ustrezno nadzorovani s prehrano in vadba. Povprečna starost bolnikov v tem preskušanju je bila 57 let, večina bolnikov (83%) pa v preteklosti ni poznala srčno-žilnih bolezni. Povprečna izhodiščna vrednost FPG in HbA1c sta bila 152 mg / dL oziroma 7,4%. Bolniki so bili naključno razporejeni z 4 mg AVANDIA enkrat na dan, 2,5 mg gliburida enkrat na dan ali 500 mg metformina enkrat na dan in odmerki so bili titrirano do optimalne glikemične kontrole do največ 4 mg dvakrat na dan za AVANDIA, 7,5 mg dvakrat na dan za gliburid in 1.000 mg dvakrat na dan za metformin. Primarni rezultat učinkovitosti je bil čas za zaporedni FPG> 180 mg / dL po vsaj 6 tednih zdravljenja odmerjen odmerek študijskega zdravila ali čas do neustreznega glikemičnega nadzora, kot je določeno z neodvisno odločitvijo komite.
Kumulativna incidenca primarnega rezultata učinkovitosti pri petih letih je bila 15% pri zdravilu AVANDIA, 21% z metforminom in 34% z gliburidom (razmerje nevarnosti 0,68 [95% CI 0,55, 0,85] v primerjavi z metforminom, HR 0,37 [95% CI 0,30, 0,45] v primerjavi z gliburidom).
Podatki o kardiovaskularnem in neželenem dogodku (vključno z učinki na telesno težo in zlom kosti) zdravila ADOPT za zdravilo AVANDIA, metformin in gliburid so opisani v OPOZORILA IN VARNOSTNI UKREPI in NEŽELENI REAKCIoz. Kot pri vseh zdravilih je treba rezultate učinkovitosti skupaj z varnostnimi informacijami upoštevati, da se oceni potencialna korist in tveganje za posameznega bolnika.
Kombinacija z metforminom ali sulfonilsečnino
Dodajanje zdravila AVANDIA bodisi metforminu bodisi sulfonilsečnini je povzročilo znatno zmanjšanje hiperglikemije v primerjavi z enim od teh zdravil. Ti rezultati so skladni z dodatnim učinkom na nadzor glikemije, kadar se AVANDIA uporablja kot kombinirano zdravljenje.
Kombinacija z metforminom
V dveh 26-tedenskih, randomiziranih, dvojno slepih, je sodelovalo 670 bolnikov s sladkorno boleznijo tipa 2, s placebom / aktivno nadzorovanimi študijami, namenjenimi oceni učinkovitosti zdravila AVANDIA v kombinaciji z metformin. Zdravilo AVANDIA, ki so ga uporabljali enkrat ali dvakrat na dan, je bilo dodano k zdravljenju bolnikov, ki niso bili nadzorovani z največjim odmerkom (2,5 grama / dan) metformina.
V eni študiji so bolniki z 2,5 grama metformina na dan neustrezno kontrolirali (povprečna izhodiščna vrednost FPG 216 mg / dL in povprečna izhodiščna vrednost 8,8% HbA1c) smo naključno prejeli 4 mg AVANDIA enkrat na dan, 8 mg AVANDIA enkrat na dan ali poleg metformin. Pri bolnikih, zdravljenih s kombinacijami zdravil, so opazili statistično pomembno izboljšanje FPG in HbA1c metformin in 4 mg AVANDIA enkrat na dan in 8 mg AVANDIA enkrat na dan, v primerjavi z bolniki, ki nadaljujejo samo z metforminom (Tabela 10).
Tabela 10. Glikemični parametri v 26-tedenski študiji kombiniranja zdravila AVANDIA Plus Metformin
| Metformin N = 113 |
AVANDIA 4 mg enkrat na dan + metformin N = 116 |
AVANDIA 8 mg enkrat na dan + metformin N = 110 |
|
| FPG (mg / dL) | |||
| Izhodišče (povprečje) | 214 | 215 | 220 |
| Sprememba od osnovne (povprečna) | 6 | -33 | -48 |
| Razlika od samega metformina (prilagojena srednja vrednost) | - | -40* | -53* |
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 20% | 45% | 61% |
| HbA1c (%) | |||
| Izhodišče (povprečje) | 8.6 | 8.9 | 8.9 |
| Sprememba od osnovne (povprečna) | 0.5 | -0.6 | -0.8 |
| Razlika od samega metformina (prilagojena srednja vrednost) | - | -1.0* | -1.2* |
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 11% | 45% | 52% |
| * p <0,0001 v primerjavi z metforminom. |
V drugi 26-tedenski študiji so bolniki s sladkorno boleznijo tipa 2 neustrezno nadzirali 2,5 grama metformina na dan, ki so bili naključno prejeti kombinacijo 4 mg AVANDIA dvakrat na dan in metformin (N = 105) je pokazal statistično pomembno izboljšanje kontrole glikemije s srednjim učinkom zdravljenja FPG -56 mg / dL in srednjim učinkom zdravljenja za HbA1c -0,8% v primerjavi z metformin sam. Kombinacija metformina in AVANDIA je povzročila nižje ravni FPG in HbA1c kot katerokoli zdravilo samo.
Bolniki, ki niso imeli ustreznega nadzorovanja največjega odmerka (2,5 grama na dan) metformina in so ga prešli na monoterapijo z zdravilom AVANDIA, so pokazali izgubo glikemičnega nadzora, kar dokazuje povečanje FPG in HbA1c. V tej skupini so opazili tudi povečanje LDL in VLDL.
Kombinacija s sulfonilsečnino
V desetih randomiziranih, dvojno slepih, s placebom / aktivno nadzorovanih študijah v eni od 24 do 26 tednov je sodelovalo 3.457 bolnikov s sladkorno boleznijo tipa 2 in eno Dveletna dvojno slepa študija z aktivnim nadzorom pri starejših bolnikih, zasnovana za oceno učinkovitosti in varnosti zdravila AVANDIA v kombinaciji z sulfonilsečnina. Zdravilo AVANDIA so dajali 2 mg, 4 mg ali 8 mg dnevno, bodisi enkrat dnevno (3 študije) bodisi v deljenih odmerkih dvakrat na dan (7 študij) bolnikom z neustreznim nadzorom submaksimalnega ali največjega odmerka sulfonilsečnina.
V teh študijah je bila kombinacija 4 mg ali 8 mg zdravila AVANDIA na dan (ki se uporablja kot enkratni ali dvakrat na dan razdeljeni odmerek) in a sulfonilsečnina je znatno zmanjšala FPG in HbA1c v primerjavi s placebom plus sulfonilsečnino ali nadalje nadgrajevala sulfonilsečnina. V preglednici 11 so prikazani združeni podatki za 8 študij, v katerih je bila AVANDIA dodana sulfonilsečnini v primerjavi s placebom in sulfonilsečnino.
Tabela 11 Glikemični parametri v kombiniranih študijah AVANDIA Plus Sulfonylurea v obdobju od 26 do 26 tednov
| Dvakrat dnevno razdeljeno odmerjanje (5 študij) | Sulfonilurea N = 397 |
AVANDIA 2 mg dvakrat dnevno + sulfonilsečnina N = 497 |
Sulfonilurea N = 248 |
AVANDIA 4 mg dvakrat na dan + sulfonilsečnina N = 346 |
| FPG (mg / dL) | ||||
| Izhodišče (povprečje) | 204 | 198 | 188 | 187 |
| Sprememba od osnovne (povprečna) | 11 | -29 | 8 | -43 |
| Razlika od same sulfonilsečnine (prilagojena srednja vrednost) | - | -42* | - | -53* |
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Izhodišče (povprečje) | 9.4 | 9.5 | 9.3 | 9.6 |
| Sprememba od osnovne (povprečna) | 0.2 | -1.0 | 0.0 | -1.6 |
| Razlika od same sulfonilsečnine (prilagojena srednja vrednost) | - | -1.1* | - | -1.4* |
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 21% | 60% | 23% | 75% |
| Odmerjanje enkrat na dan (3 študije) | Sulfonilurea N = 172 |
AVANDIA 4 mg enkrat na dan + sulfonilsečnina N = 172 |
Sulfonilurea N = 173 |
AVANDIA 8 mg enkrat na dan + sulfonilsečnina N = 176 |
| FPG (mg / dL) | ||||
| Izhodišče (povprečje) | 198 | 206 | 188 | 192 |
| Sprememba od osnovne (povprečna) | 17 | -25 | 17 | -43 |
| Razlika od same sulfonilsečnine (prilagojena srednja vrednost) | - | -47* | - | -66* |
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Izhodišče (povprečje) | 8.6 | 8.8 | 8.9 | 8.9 |
| Sprememba od osnovne (povprečna) | 0.4 | -0.5 | 0.1 | -1.2 |
| Razlika od same sulfonilsečnine (prilagojena srednja vrednost) | - | -0.9* | - | -1.4* |
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 11% | 36% | 20% | 68% |
| * p <0,0001 v primerjavi s samo sulfonilsečnino. |
Ena od 24 do 26 tedenskih raziskav je vključevala bolnike, ki so bili kot monoterapija neustrezno nadzorovani pri največjih odmerkih gliburida in so prešli na 4 mg AVANDIA na dan; v tej skupini so pokazali izgubo nadzora glikemije, kar dokazujejo povečanje FPG in HbA1c.
V dvoletni dvojno slepi študiji so bili starejši bolniki (stari od 59 do 89 let) s polovično največjo sulfonilsečnino (glipizid 10 mg dvakrat na dan) naključno razvrščeni v dodajanje AVANDIA (n = 115, 4 mg enkrat na 8 mg po potrebi) ali nadaljevanje zvišanja titracije glipizida (n = 110) do največ 20 mg dvakrat dnevno. Povprečna izhodiščna vrednost FPG in HbA1c sta bila 157 mg / dL oziroma 7,72% za roko AVANDIA plus glipizid in 159 mg / dL oziroma 7,65% za roko s titracijo glipizida. Izguba glikemične kontrole (FPG - 180 mg / dL) se je pojavila pri bistveno nižjem deležu bolnikov (2%), ki so prejemali zdravilo AVANDIA plus glipizid, v primerjavi z bolniki v veji z titracijo glipizida (28,7%). Približno 78% bolnikov na kombinirani terapiji je zaključilo dve leti zdravljenja, le 51% pa jih je bilo na monoterapiji z glipizidom. Vpliv kombiniranega zdravljenja na FPG in HbA1c je bil pri dvoletnem študijskem obdobju trajen doseganje povprečne vrednosti 132 mg / dL za FPG in povprečje 6,98% za HbA1c v primerjavi s spremembami glipizida roka.
Kombinacija z metforminom Sulfonilurea Plus
V dveh od 24 do 26 tednov dvojno slepih, s placebom nadzorovanih študijah, namenjenih oceni učinkovitosti in varnosti zdravila AVANDIA v kombinaciji s sulfonilsečnino in metforminom, AVANDIA 4 mg ali 8 mg dnevno, dajali so ga v razdeljenih odmerkih dvakrat na dan, bolnikom z neustreznim nadzorom submaksimalnih (10 mg) in največjih (20 mg) odmerkov gliburida in največjega odmerka metformina (2 g / dan). Pri bolnikih, zdravljenih s kombinacijami sulfonilsečnine, so opazili statistično pomembno izboljšanje FPG in HbA1c. plus metformin in 4 mg AVANDIA in 8 mg AVANDIA v primerjavi z bolniki so nadaljevali s sulfonilsečnino in metforminom, kot je prikazano v preglednici 12.
Tabela 12 Glikemični parametri v 26-tedenski študiji kombiniranja AVANDIA Plus sulfonilsečnine in metformina
| Sulfonilurea + metformin N = 273 |
AVANDIA 2 mg dvakrat dnevno + sulfonilsečnina + metformin N = 276 |
AVANDIA 4 mg dvakrat na dan + sulfonilsečnina + metformin N = 277 |
|
| FPG (mg / dL) | |||
| Izhodišče (povprečje) | 189 | 190 | 192 |
| Sprememba od osnovne (povprečna) | 14 | -19 | -40 |
| Razlika od sulfonilsečnine in metformina (prilagojena srednja vrednost) | - | -30* | -52* |
| % bolnikov z ¥ mg 30 mg / dL zniža od izhodiščne vrednosti | 16% | 46% | 62% |
| HbA1c (%) | |||
| Izhodišče (povprečje) | 8.7 | 8.6 | 8.7 |
| Sprememba od osnovne (povprečna) | 0.2 | -0.4 | -0.9 |
| Razlika od sulfonilsečnine in metformina (prilagojena srednja vrednost) | - | -0.6* | -1.1* |
| % bolnikov z 0,7% zniža od izhodiščne vrednosti | 16% | 39% | 63% |
| * p <0,0001 v primerjavi s placebom. |
vrh
Reference
- Dokumentacija o uporabi hrane in zdravil. Skupno srečanje Svetovalnih odborov za metabolične droge Endocrino ter za varnost drog in upravljanje tveganj Ju 2007.
- DREAM sojenje preiskovalcem. Vpliv rosiglitazona na pogostost sladkorne bolezni z oslabljeno toleranco za glukozo ali oslabljeno glukozo na tešče: naključni nadzor Lancet 2006;368:1096-1105.
- Domov PD, Pocock SJ, Beck-Nielsen H et al. Rosiglitazon je bil ocenjen glede kardiovaskularnih izidov - vmesna analiza. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH idr. Vpliv rifampina na farmakokinetiko rosiglitazona pri zdravih osebah. Clin Pharmacol Ther 2004; 75: 157-162.
vrh
Kako dobava / skladiščenje in ravnanje
Vsaka peterokotna filmsko obložena tableta TILTAB vsebuje rosiglitazon kot maleat, kot sledi: 2 mg-roza, vtisnjeno s SB na eni strani in 2 na drugi; 4 mg oranžno, vtisnjeno s SB na eni strani in 4 na drugi strani; 8 mg rdeče-rjave barve, vtisnjeno s SB na eni strani in 8 na drugi strani.
- 2 mg stekleničke po 60: NDC 0029-3158-18
- 4 mg stekleničke po 30: NDC 0029-3159-13
- 4 mg stekleničke po 90: NDC 0029-3159-00
- 8 mg stekleničke po 30: NDC 0029-3160-13
- 8 mg steklenice 90: NDC 0029-3160-59
Shranjujte pri temperaturi 25 ° C; izleti 15 do 30 C (59 do 86 F). Razpršite v tesni, odporni na svetlobo.
nazadnje posodobljeno 02/2008
Avandia, rosiglitazon maleat, podatki o bolniku (v navadni angleščini)
Podrobne informacije o znakih, simptomih, vzrokih, zdravljenju sladkorne bolezni
Informacije v tej monografiji ne zajemajo vseh možnih načinov uporabe, navodil, previdnostnih ukrepov, interakcij z zdravili ali škodljivih učinkov. Te informacije so posplošene in niso mišljene kot poseben zdravniški nasvet. Če imate vprašanja o zdravilih, ki jih jemljete ali bi želeli več informacij, se posvetujte s svojim zdravnikom, farmacevtom ali medicinsko sestro.
nazaj k:Preglejte vsa zdravila za zdravljenje sladkorne bolezni


