Namenda: Alzheimerjevo zdravilo
Namenda je zdravilo, ki se uporablja pri zdravljenju Alzheimerjeve bolezni. Podrobne informacije o uporabi, odmerjanju, stranskih učinkih zdravila Namenda.
Blagovna znamka: Namenda
Splošno ime: Memantin hidroklorid
Namenda (memantinski hidroklorid) je zdravilo, ki se uporablja pri zdravljenju Alzheimerjeve bolezni. Spodaj so podrobne informacije o uporabi, odmerjanju in neželenih učinkih zdravila Namenda.
Vsebina:
Opis
Farmakologija
Indikacije in uporaba
Kontraindikacije
Previdnostni ukrepi
Interakcije z zdravili
Neželeni učinki
Predoziranje
Odmerjanje
Na voljo v kompletu
Navodila za pacienta
Podatki o bolniku Namenda (v običajni angleščini)
Opis
Namenda® (memantin hidroklorid) je oralno aktivni antagonist receptorjev NMDA. Kemično ime za memantinijev klorid je 1-amino-3,5-dimetiladamantanov hidroklorid z naslednjo strukturno formulo:
Vir: Forest Laboratories, ameriški distributer ali Namenda.
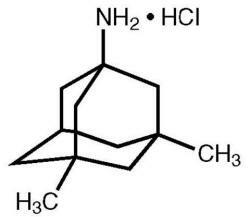
Molekularna formula je C12H21N · HCl, molekulska teža pa 215,76.
Memantin HCl se pojavlja kot lep bel do skoraj bel prah in je topen v vodi. Zdravilo Namenda je na voljo v obliki tablet ali kot peroralna raztopina. Zdravilo Namenda je na voljo za peroralno dajanje v obliki kapsul v obliki filmsko obloženih tablet, ki vsebujejo 5 mg in 10 mg memantinijevega klorida. Tablete vsebujejo tudi naslednje neaktivne sestavine: mikrokristalna celuloza, laktoza monohidrat, koloidni silicijev dioksid, talk in magnezijev stearat. Poleg tega so kot sestavni deli filmskega nanosa prisotne tudi naslednje neaktivne sestavine: hipromeloza, triacetin, titanov dioksid, FD&C rumena # 6 in FD&C modra # 2 (5 mg tablete), črn železov oksid (10 mg tablete). Peroralna raztopina zdravila Namenda vsebuje memantin hidroklorid v jakosti 2 mg memantinijevega klorida v vsakem ml. Peroralna raztopina vsebuje tudi naslednje neaktivne sestavine: raztopina sorbitola (70%), metil paraben, propilparaben, propilen glikol, glicerin, naravna aroma poprove mete # 104, citronska kislina, natrijev citrat in prečiščena voda.
Klinična farmakologija
Mehanizem delovanja in farmakodinamika
Vztrajno aktiviranje receptorjev N-metil-D-aspartata (NMDA) centralnega živčnega sistema s pomočjo za ekscitatorno aminokislino glutamat je domneval, da prispeva k simptomatologiji Alzheimerjeva bolezen. Memantin je zasnovan tako, da svoje terapevtsko delovanje izvaja s svojim delovanjem kot nizko do zmerno afiniteto nekonkurenčen (odprti kanal) antagonist receptorja NMDA, ki se prednostno veže na NMDA receptor kationskih kanalov. Ni dokazov, da memantin preprečuje ali upočasnjuje nevrodegeneracijo pri bolnikih z Alzheimerjevo boleznijo.
Memantin je pokazal nizko do zanemarljivo afiniteto za GABA, benzodiazepinske, dopaminske, adrenergične, histaminske in glicinske receptorje ter za napetostno odvisne kanale Ca 2+, Na + ali K +. Memantin je pokazal tudi antagonistične učinke na receptorju 5HT 3 s potenco, podobno kot za receptor NMDA in blokirani nikotinski acetilholinski receptorji z enim od šeste do ene desetine potenca
Študije in vitro so pokazale, da memantin ne vpliva na reverzibilno inhibicijo acetilholinesteraze donepezilom, galantaminom ali takrinom.
Farmakokinetika
Memantin se po peroralni uporabi dobro absorbira in ima linearno farmakokinetiko v območju terapevtskega odmerka. Izloča se pretežno z urinom, nespremenjen in ima končni razpolovni čas izločanja približno 60-80 ur.
Absorpcija in porazdelitev
Po peroralni uporabi se memantin močno absorbira, ko doseže najvišjo koncentracijo v približno 3-7 urah. Hrana nima vpliva na absorpcijo memantina. Povprečni volumen porazdelitve memantina je 9-11 L / kg, vezava na plazemski protein pa je nizka (45%).
Presnova in izločanje
Memantin je podvržen delni presnovi v jetrih. Približno 48% danega zdravila se izloči nespremenjeno v urinu; preostanek se pretvori predvsem v tri polarne presnovke, ki imajo minimalni receptor NMDA antagonistična aktivnost: N-glukuronidni konjugat, 6-hidroksi memantin in 1-nitrozo deaminiran memantina. Skupno 74% danega odmerka se izloči kot vsota matičnega zdravila in konjugata N-glukuronida. Jetrni mikrosomalni encimski sistem CYP450 nima pomembne vloge pri presnovi memantina. Razpolovna doba izločanja memantina je približno 60-80 ur. Ledvični očistek vključuje aktivno tubularno sekrecijo, ki jo moderira cevska reabsorpcija, odvisna od pH.
Posebne populacije
Ledvična okvara: Farmakokinetiko memantina so ovrednotili po enkratnem peroralnem dajanju 20 mg memantin HCl pri 8 osebah z blago ledvično okvaro (očistek kreatinina, CLcr,> 50 - 80 ml / min), 8 oseb z zmerno okvaro ledvic (CLcr 30 - 49 ml / min), 7 oseb s hudo okvaro ledvic (CLcr 5 - 29 ml / min) in 8 zdravih oseb (CLcr> 80 ml / min) se po starosti, teži in spolu čim bolj ujema z osebami z ledvicami oslabitev. Povprečna AUC 0- (neskončnost) se je pri osebah z blago, zmerno in hudo okvaro ledvic povečala za 4%, 60% in 115% v primerjavi z zdravimi osebami. Končni razpolovni čas izločanja se je pri osebah z blago, zmerno in hudo okvaro ledvic povečal za 18%, 41% in 95% v primerjavi z zdravimi osebami.
Pri bolnikih z blago in zmerno okvaro ledvic odmerka ni priporočljivo. Odmerjanje je treba zmanjšati pri bolnikih s hudo okvaro ledvic (glejte ODMERJANJE IN UPORABA).
Starejši: Farmakokinetika zdravila Namenda pri mladih in starejših osebah je podobna.
Spol: Po večkratnem dajanju zdravila Namenda 20 mg b.i.d., so imele ženske pri približno 45% večjo izpostavljenost kot moški, vendar ni bilo razlike v izpostavljenosti, če se je upoštevala telesna teža.
Interakcije med drogami
Podloge mikrosomalnih encimov: Študije in vitro so pokazale, da pri koncentracijah, ki presegajo tiste, povezane z učinkovitostjo, memantin ne inducira citokrom P450 izocimov CYP1A2, CYP2C9, CYP2E1 in CYP3A4 / 5. Poleg tega so študije in vitro pokazale, da memantin povzroči minimalno inhibicijo encimov CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 in CYP3A4. Ti podatki kažejo, da ni pričakovati nobenih farmakokinetičnih interakcij z zdravili, ki jih metabolizirajo ti encimi.
Inhibitorji mikrosomalnih encima: Ker je memantin podvržen minimalni presnovi, pri čemer se večina odmerka izloči v urinu nespremenjena, interakcija med memantinom in zdravili, ki so zaviralci encimov CYP450, malo verjetna. Sočasna uporaba zdravila Namenda z zaviralcem AChE donepezila HCl ne vpliva na farmakokinetiko nobene spojine.
Zdravila se izločajo z ledvičnimi mehanizmi: Memantin se deloma izloči s cevastim izločanjem. Študije in vivo so pokazale, da večkratni odmerki diuretičnega hidroklorotiazida / triamterena (HCTZ / TA) v stanju dinamičnega ravnovesja niso vplivali na AUC memantina. Memantin ni vplival na biološko uporabnost TA in znižal AUC in C max HCTZ za približno 20%. Sočasna uporaba memantina z antihiperglikemičnim zdravilom Glucovance® (gliburid in metformin HCl) ni vplivala na farmakokinetiko memantina, metformina in gliburida. Memantin ni spremenil učinka Glucovance® na znižanje glukoze v serumu, kar kaže na odsotnost farmakodinamične interakcije.
Zdravila, zaradi katerih je urin alkalen: Očistek memantina se je pri pH 8 zmanjšal za približno 80%. Zato lahko spremembe pH urina v alkalnem stanju povzročijo kopičenje zdravila z možnim povečanjem škodljivih učinkov. Pričakuje se, da bodo zdravila, ki alkalizirajo urin (npr. Zaviralci ogljikove anhidraze, natrijev bikarbonat), zmanjšali ledvično izločanje memantina.
Zdravila, ki se močno vežejo na plazemske beljakovine: Ker je vezava memantina na plazemske beljakovine majhna (45%), interakcija z zdravili, ki so močno vezana na plazemske beljakovine, kot sta varfarin in digoksin, ni verjetna.
KLINIČNIH PRESKUŠANJ
Učinkovitost zdravila Namenda (memantinijev klorid) kot zdravljenje bolnikov z zmerno do hudo Alzheimerjevo boleznijo je bila dokazana v dveh randomiziranih, dvojno slepe, s placebom nadzorovane klinične študije (Študiji 1 in 2), izvedene v ZDA, ki so ocenile tako kognitivno delovanje kot vsakodnevno delovanje. Povprečna starost bolnikov, ki so sodelovali v teh dveh preskušanjih, je bila 76, v razponu 50-93 let. Približno 66% bolnikov je bilo ženskega spola in 91% bolnikov belcev.
Tretja študija (Študija 3), opravljena v Latviji, je vključila bolnike s hudo demenco, vendar kognitivne funkcije niso ocenili kot načrtovano končno točko.
Izidni ukrepi študije: V vsaki ameriški študiji je bila učinkovitost Namenda določena z obema instrumentoma zasnovan za oceno celotne funkcije s pomočjo ocene skrbnika in instrumenta, ki meri spoznanje. Obe študiji sta pokazali, da so se pri bolnikih na zdravili Namenda občutno izboljšali obe ukrepi v primerjavi s placebom.
Vsakodnevne funkcije so bile ocenjene v obeh študijah s pomočjo spremenjene skupne študije Alzheimerjeve bolezni - dejavnosti dnevnega inventarja (ADCS-ADL). ADCS-ADL je sestavljen iz izčrpne baterije vprašanj o ADL, ki se uporabljajo za merjenje funkcionalnih sposobnosti bolnikov. Vsak izdelek ADL je ocenjen od najvišje stopnje neodvisnih zmogljivosti do popolne izgube. Preiskovalec opravi popis tako, da opravi razgovor z negovalcem, ki je seznanjen z vedenjem bolnika. Podmnožica 19 elementov, vključno z ocenami bolnikove sposobnosti prehranjevanja, oblačenja, kopanja, telefona, potovanja, trgovine, in opravljanje drugih gospodinjskih opravil je bilo potrjeno za oceno bolnikov z zmerno do hudo demenca. To je spremenjeni ADCS-ADL, ki ima točkovanje od 0 do 54, pri čemer spodnji rezultati kažejo na večjo funkcionalno okvaro.
Sposobnost Namende za izboljšanje kognitivnih lastnosti je bila ocenjena v obeh študijah s baterijo za resno okvaro (SIB), instrument z več postavkami, ki je bil potrjen za oceno kognitivnih funkcij pri bolnikih z zmerno do hudo demenca. SIB preučuje izbrane vidike kognitivne uspešnosti, vključno z elementi pozornosti, orientacije, jezika, spomina, vizualno prostorske sposobnosti, konstrukcije, prakse in socialne interakcije. Razpon točkovanja SIB je od 0 do 100, nižji rezultati pa kažejo na večjo kognitivno okvaro.
Študija 1 (osemindvajseti študij)
V raziskavi, ki je trajala 28 tednov, je bilo 252 bolnikov z zmerno do hudo verjetno Alzheimerjevo boleznijo (diagnosticirano z DSM-IV in NINCDS-ADRDA merila, z oceno Mini-Mental State Examination> / = 3 in! - = 14 in Stopnjami globalne stopnje poslabšanja 5-6) so bili naključno razvrščeni v Namenda oz. placebo. Za bolnike, randomizirane na zdravilo Namenda, smo začeli zdravljenje s 5 mg enkrat na dan in tedensko povečali za 5 mg / dnevno v odmerkih, razdeljenih na odmerek 20 mg / dan (10 mg dvakrat na dan).
Učinki na ADCS-ADL:
Slika 1 prikazuje časovni potek spremembe glede na izhodiščno vrednost ocene ADCS-ADL za bolnike v dveh skupinah zdravljenja, ki so zaključile 28 tednov študije. Pri 28 tednih zdravljenja je bila povprečna razlika v ocenah sprememb ADCS-ADL pri bolnikih, ki so prejemali zdravilo Namenda, 3,4 enote. Z analizo, ki je temeljila na vseh bolnikih, in z zadnjim opazovanjem študije (LOCF analiza) je bilo zdravljenje z zdravilom Namenda statistično značilno boljše od placeba.
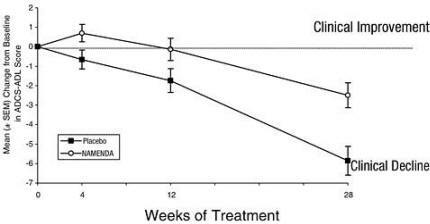
Slika 1: Časovni potek spremembe vrednosti iz ADCS-ADL glede na izhodišče za bolnike, ki so zaključili 28 tednov zdravljenja.
Slika 2 prikazuje kumulativne odstotke pacientov iz vsake od skupin zdravljenja, ki so dosegli vsaj spremembo ADCS-ADL, prikazano na osi X.
Krivulje kažejo, da imata tako bolniki, ki so bili dodeljeni zdravilom Namenda kot placebo, široko paleto odzivov in na splošno kažejo poslabšanje (a negativna sprememba ADCS-ADL v primerjavi z izhodiščem), vendar je bolj verjetno, da bo skupina Namenda pokazala manjši upad oz. izboljšava. (V prikazu kumulativne porazdelitve bi se krivulja za učinkovito zdravljenje premaknila v levo od krivulje za placebo, medtem ko bi neučinkovito ali škodljivo zdravljenje prekrivalo ali pomaknilo v desno od krivulje za placebo.)
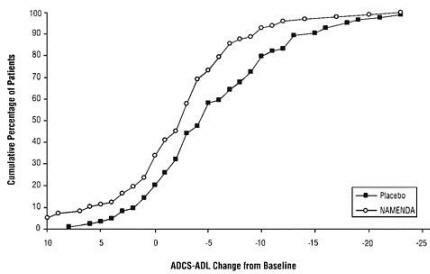
Slika 2: Kumulativni odstotek bolnikov, ki so dopolnili 28 tednov dvojno slepega zdravljenja z določenimi spremembami glede na izhodiščne vrednosti ADCS-ADL rezultatov.
Učinki na SIB: Slika 3 prikazuje časovni potek sprememb glede na izhodišče za oceno SIB za dve skupini zdravljenja v 28 tednih študije. Pri 28 tednih zdravljenja je bila povprečna razlika v rezultatih spremembe SIB pri bolnikih, ki so zdravili zdravilo Namenda, v primerjavi z bolniki s placebom 5,7 enot. Z uporabo LOCF analize je bilo zdravljenje z zdravilom Namenda statistično značilno boljše od placeba.
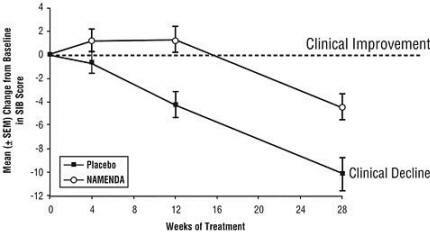
Slika 3: Časovni potek spremembe glede na izhodiščno vrednost SIB za bolnike, ki so zaključili 28 tednov zdravljenja.
Slika 4 prikazuje kumulativne odstotke pacientov iz vsake skupine zdravljenja, ki so dosegli vsaj merilo spremembe ocene SIB, prikazano na osi X.
Krivulje kažejo, da imajo tako bolniki, ki so bili dodeljeni Namendi kot placebo, široko paleto odzivov in na splošno kažejo poslabšanje, toda bolj verjetno je, da skupina Namenda kaže manjši upad oz izboljšava.
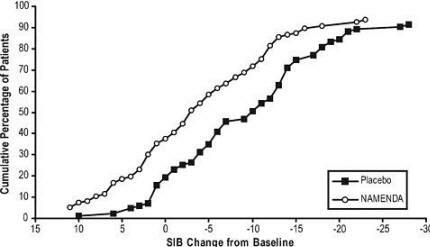
Slika 4: Kumulativni odstotek bolnikov, ki so dopolnili 28 tednov dvojno slepega zdravljenja z določenimi spremembami glede na izhodišče v SIB rezultatih.
Študija 2 (štiriindvajsetletna študija) V 24-tedenski študiji je bilo 404 bolnikov z zmerno do hudo verjetna Alzheimerjeva bolezen (diagnosticirana po kriterijih NINCDS-ADRDA, z Mini-Mental State Pregled zadetkov ≥ 5 in ≤ 14) ki se je zdravil z donepezilom najmanj 6 mesecev in je bil odmerek stabilnega donepezil v zadnjih 3 mesecih so bili med preskušanjem randomizirani na zdravilo Namenda ali placebo donepezil. Za bolnike, randomizirane na zdravilo Namenda, smo začeli zdravljenje s 5 mg enkrat na dan in tedensko povečali za 5 mg / dan v deljenih odmerkih na odmerek 20 mg / dan (10 mg dvakrat na dan).
Učinki na ADCS-ADL: Slika 5 prikazuje časovni potek spremembe od izhodišča v oceni ADCS-ADL za dve skupini zdravljenja v 24 tednih študije. Po 24 tednih zdravljenja je bila povprečna razlika v spremembi ocene ADCS-ADL za zdravilo Namenda / donepezil zdravljenih bolnikov (kombinirano zdravljenje) v primerjavi z bolniki, ki so prejemali placebo / donepezil (monoterapija), je bilo 1,6 enot. Z uporabo LOCF analize je bilo zdravljenje z zdravilom Namenda / donepezil statistično značilno boljše od placeba / donepezila.
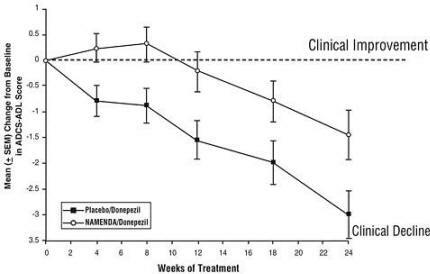
Slika 5: Časovni potek spremembe vrednosti iz ADCS-ADL glede na izhodišče za bolnike, ki so zaključili 24 tednov zdravljenja.
Slika 6 prikazuje kumulativne odstotke pacientov iz vsake od skupin zdravljenja, ki so dosegli vsaj merilo izboljšanja ADCS-ADL, prikazano na osi X.
Krivulje kažejo, da imata tako bolniki, ki so bili imenovani zdravilo Namenda / donepezil kot placebo / donepezil, širok razpon odzivov in na splošno kažejo poslabšanje, vendar je bolj verjetno, da bo skupina Namenda / donepezil manjša upad ali an izboljšava.

Slika 6: Kumulativni odstotek bolnikov, ki so v 24 tednih dvakrat slepega zdravljenja zaključili z določenimi spremembami glede na izhodiščne vrednosti ADCS-ADL.
Učinki na SIB: Slika 7 prikazuje časovni potek spremembe glede na izhodiščno vrednost SIB za dve skupini zdravljenja v 24 tednih študije. V 24 tednih zdravljenja je bila povprečna razlika v rezultatih spremembe SIB pri bolnikih, zdravljenih z zdravilom Namenda / donepezil, v primerjavi z bolniki, ki so prejemali placebo / donepezil, 3,3 enote. Z uporabo LOCF analize je bilo zdravljenje z zdravilom Namenda / donepezil statistično značilno boljše od placeba / donepezila.

Slika 7: Časovni potek spremembe glede na izhodiščno oceno SIB za bolnike, ki so zaključili 24 tednov zdravljenja.
Slika 8 prikazuje kumulativne odstotke bolnikov iz vsake skupine zdravljenja, ki so dosegli vsaj merilo izboljšanja ocene SIB, prikazano na osi X.
Krivulje kažejo, da imata tako bolniki, ki so bili imenovani zdravilo Namenda / donepezil kot placebo / donepezil, široko območje odzivov, vendar je večja verjetnost, da bo skupina Namenda / donepezil izboljšala ali zmanjšala upad.
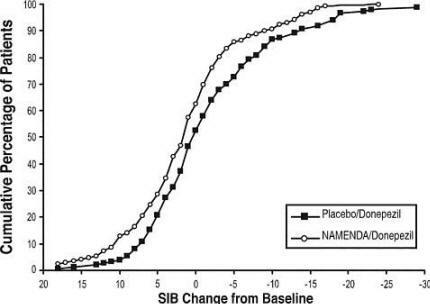
Slika 8: Kumulativni odstotek bolnikov, ki so 24 tednov zaključili dvojno slepo zdravljenje z določenimi spremembami glede na izhodišče v SIB rezultatih.
Študija 3 (Dvanajsttedenska študija) V dvojno slepi študiji, ki je trajala 12 tednov, v bolnišnicah za ostarele v Latviji, je bilo 166 bolnikov z demenco do DSM-III-R, ocena mini-mentalnega stanja <10 in globalna stopnja poslabšanja od 5 do 7 so bili naključno razporejeni na Namenda ali placebo. Za bolnike, randomizirane na zdravilo Namenda, smo začeli zdravljenje s 5 mg enkrat na dan in po 1 tednu zvišali na 10 mg enkrat na dan. Primarni ukrepi za učinkovitost so bili podkalcela odvisnosti od oskrbe lestvice ocenjevanja vedenja za paciente (BGP), merilo vsakodnevne funkcije in klinični globalni vtis sprememb (CGI-C), merilo celotne klinične učinek. V tej raziskavi niso uporabili nobene veljavne mere kognitivne funkcije. Pri obeh glavnih ukrepih učinkovitosti je bila opažena statistično pomembna razlika v zdravljenju v 12 tednih, ko je bilo naklonjeno zdravilo Namenda nad placebom. Ker so bili vpisani bolniki mešanica Alzheimerjeve bolezni in vaskularne demence, smo poskušali ločiti dve skupini in vse Bolniki so bili pozneje določeni kot žilne demence ali Alzheimerjeve bolezni, na podlagi njihovih rezultatov na lestvici Hašinski ishemije v študiji vnos. Le približno 50% bolnikov je imelo računalniško tomografijo možganov. Za podskupino, za katero je bilo določeno, da ima Alzheimerjevo bolezen, so opazili statistično pomemben učinek zdravljenja, ki je ugodneje vplival na zdravilo Namenda nad placebom v 12 tednih, tako na BGP kot na CGI-C.
Indikacije in uporaba
Zdravilo Namenda (memantinijev klorid) je indicirano za zdravljenje zmerne do hude demence Alzheimerjevega tipa.
Kontraindikacije
Zdravilo Namenda (memantinijev klorid) je kontraindicirano pri bolnikih z znano preobčutljivostjo za memantin hidroklorid ali katero koli pomožno snov, uporabljeno v formulaciji.
Previdnostni ukrepi
Informacije za bolnike in negovalce: Negovane osebe morajo biti poučene o priporočeni uporabi (dvakrat na dan za odmerke nad 5 mg) in povečanju odmerka (najmanjši interval v enem tednu med povečanjem odmerka).
Napadi nevroloških stanj:
Pri bolnikih z napadom epileptičnih napadov zdravila Namenda niso sistematično ocenjevali. V kliničnih preskušanjih zdravila Namenda so se napadi pojavili pri 0,2% bolnikov, zdravljenih z zdravilom Namenda, in 0,5% bolnikov, ki so prejemali placebo.
Pogoji genitourinarstva
Pogoji, ki povečajo pH urina, lahko zmanjšajo izločanje memantina v urinu, kar ima za posledico povečano plazemsko raven memantina.
Posebne populacije
Okvara jeter
Zdravilo Namenda poteka delno v jetrni presnovi, pri čemer se približno 48% uporabljenega odmerka izloči z urinom kot nespremenjeno zdravilo ali kot vsota matičnega zdravila in konjugata N-glukuronida (74%). Farmakokinetika memantina pri bolnikih z okvaro jeter ni bila raziskana, vendar naj bi bilo le skromno prizadeto.
Ledvična okvara
Pri bolnikih z blago ali zmerno okvaro ledvic prilagajanje odmerka ni potrebno. Pri bolnikih s hudo okvaro ledvic je priporočljivo zmanjšanje odmerka (glejte KLINIČNA FARMAKOLOGIJA in ODDELEK IN UPORABA ).
Interakcije med drogami
N-metil-D-aspartat (NMDA) antagonisti: Kombinirana uporaba zdravila Namenda z drugimi antagonisti NMDA (amantadin, ketamin in dekstrometorfan) ni bila sistematično ocenjena, zato je treba k tej uporabi pristopiti previdno.
Učinki Namende na substrate mikrosomalnih encimov: Študije in vitro, izvedene z markernimi substrati encimov CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4), so pokazale minimalno inhibicijo teh encimov s memantinom. Raziskave in vitro poleg tega kažejo, da pri koncentracijah, ki presegajo tiste, povezane z učinkovitostjo, memantin ne inducira citokrom P450 izocimov CYP1A2, CYP2C9, CYP2E1 in CYP3A4 / 5. Ne pričakujemo farmakokinetičnih interakcij z zdravili, ki jih presnavljajo ti encimi.
Vpliv zaviralcev in / ali substratov mikrosomalnih encimov na zdravilo Namenda: Memantin se večinoma izloča preko ledvic in od drog, ki so substrati in / ali zaviralci sistema CYP450, se ne pričakuje, da bodo spremenile presnovo memantina.
Zaviralci acetilkolinesteraze (AChE): Sočasna uporaba zdravila Namenda z zaviralcem AChE donepezila HCl ni vplivala na farmakokinetiko nobene spojine. V 24-tedenski kontrolirani klinični študiji pri bolnikih z zmerno do hudo Alzheimerjevo boleznijo so bili škodljivi profil dogodkov, opažen s kombinacijo memantina in donepezila, je bil podoben kot pri samopepezilu.
Zdravila se izločajo z ledvičnimi mehanizmi: Ker se memantin delno izloča s cevastim izločanjem, sočasno jemanje zdravil, ki uporabljajo enak ledvični kationski sistem, vključno z hidroklorotiazid (HCTZ), triamteren (TA), metformin, cimetidin, ranitidin, kinidin in nikotin lahko povzročijo spremenjene ravni v plazmi obeh agentov. Vendar sočasna uporaba zdravila Namenda in HCTZ / TA ni vplivala na biološko uporabnost niti memantina niti TA, biološka uporabnost HCTZ pa se je zmanjšala za 20%. Poleg tega sočasna uporaba memantina z antihiperglikemičnim zdravilom Glucovance® (gliburid in metformin HCl) ni vplivala na farmakokinetiko memantina, metformina in gliburida. Poleg tega memantin ni spremenil učinka Glucovance® na znižanje glukoze v serumu.
Zdravila, zaradi katerih je urin alkalen: Očistek memantina se je pri pH 8 zmanjšal za približno 80%. Zato lahko spremembe pH urina proti alkalnemu stanju povzročijo kopičenje zdravila z možnim povečanjem škodljivih učinkov. PH urina se spremeni s prehrano, zdravili (npr. Zaviralci ogljikove anhidraze, natrijevim bikarbonatom) in kliničnim stanjem bolnika (npr. Ledvična tubularna acidoza ali hude okužbe sečil). Zato je treba memantin v teh pogojih uporabljati previdno.
Kancerogeneza, mutageneza in oslabitev plodnosti
V 113-tedenski peroralni študiji pri miših pri odmerkih do 40 mg / kg / dan (10-kratnik največjega priporočenega odmerka pri ljudeh [MRHD] na osnovi mg / m 2) ni bilo dokazov o rakotvornosti. Prav tako ni bilo dokazov o kancerogenosti pri podganah, peroralno odmerjenih do 40 mg / kg / dan 71 tednov sledi 20 mg / kg / dan (20 in 10-krat MRHD na osnovi mg / m 2) v 128 tednih.
Memantin ni pokazal nobenega genotoksičnega potenciala, ko so ga ocenjevali v in vitro S. tifimurium ali E. preskus reverzne mutacije coli, test in vitro kromosomske aberacije na človeških limfocitih, in vivo test citogenetike za poškodbe kromosomov pri podganah in in vivo test na mikronukleusu miši. Rezultati so bili nedvoumni v in vitro testu mutacije genov z uporabo celic kitajskega hrčka V79.
Pri podganah, ki so dobivale do 18 mg / kg / dan (9-krat več kot MRHD na mg / m 2 osnovi) peroralno 14 dni pred parjenjem v obdobju brejosti in laktacije pri samicah ali 60 dni pred parjenjem v samci.
Nosečnost
Kategorija B nosečnosti: Memantin, ki so ga oralno dajali nosečim podganam in brejim kuncem v obdobju organogeneze, ni bil teratogen do najvišjih preskušenih odmerkov. (18 mg / kg / dan pri podganah in 30 mg / kg / dan pri kuncih, kar je 9 oziroma 30-krat največji priporočeni odmerek pri ljudeh [MRHD] na mg / m 2 osnova).
Pri peroralni uporabi so opazili rahlo strupenost za mater, zmanjšano maso zenic in povečano pojavnost neostriženih vratnih vretenc. odmerek 18 mg / kg / dan v študiji, v kateri so podgane prejemale peroralno memantin, ki se je začelo pred parjenjem in nadaljevalo skozi poporodni čas obdobje. Pri tem odmerku so opazili tudi rahlo strupenost za mater in zmanjšano telesno maso mladičev v študiji, v kateri so podgane zdravili od 15. meseca brejosti v obdobju po porodu. Odmerek brez učinka za te učinke je bil 6 mg / kg, kar je 3-krat več kot MRHD na osnovi mg / m2.
Ni ustreznih in dobro nadzorovanih študij memantina pri nosečnicah. Zdravilo Memantin je treba uporabljati med nosečnostjo le, če potencialna korist upravičuje potencialno tveganje za plod.
Doječe matere
Ni znano, ali se memantin izloča v materino mleko. Ker se v materino mleko izloča veliko zdravil, je treba previdnost uporabljati pri doječi materi.
Uporaba pri otrocih
Ni ustreznih in dobro nadzorovanih preskušanj, ki bi dokumentirale varnost in učinkovitost memantina pri kateri koli bolezni, ki se pojavi pri otrocih.
Neželeni učinki
Izkušnje, opisane v tem poglavju, izhajajo iz študij pri bolnikih z Alzheimerjevo boleznijo in vaskularno demenco.
Neželeni dogodki, ki vodijo do prekinitve: V placebo nadzorovanih preskušanjih, v katerih so bolniki z demenco prejemali odmerke zdravila Namenda do 20 mg / dan, verjetnost prekinitve zaradi neželenega dogodka je bila v skupini z zdravilom Namenda enaka kot pri placebu skupina. Noben posamezni neželeni učinek ni bil povezan s prekinitvijo zdravljenja pri 1% ali več bolnikov, zdravljenih z zdravilom Namenda, in s hitrostjo, večjo od placeba.
Neželeni dogodki, o katerih so poročali v kontroliranih preskušanjih: Poročani neželeni dogodki v preskušanjih Namenda (memantinijev klorid) odražajo izkušnje, pridobljene pod natančno nadzorovanimi pogoji pri zelo izbrani populaciji bolnikov. V dejanski praksi ali v drugih kliničnih preskušanjih te ocene pogostnosti morda ne veljajo, saj se lahko pogoji uporabe, vedenje poročanja in vrste zdravljenih bolnikov razlikujejo. V preglednici 1 so navedeni znaki in simptomi, ki se pojavljajo pri zdravljenju, o katerih so poročali pri vsaj 2% bolnikov s placebom pod nadzorom preskušanja z demenco in pri katerih je bila stopnja pojavnosti pri bolnikih, zdravljenih z zdravilom Namenda, večja kot pri tistih, ki so jih zdravili placebo. Noben neželeni učinek se ni pojavil s pogostostjo najmanj 5% in dvakrat večjo stopnjo placeba.
Sistem telesa |
Placebo (N = 922) % |
Namenda (N = 940) % |
Telo kot celota | ||
Utrujenost |
1 | 2 |
Bolečina |
1 | 3 |
Srčnožilni sistem | ||
Hipertenzija |
2 | 4 |
Centralni in periferni živčni sistem | ||
Omotičnost |
5 | 7 |
Glavobol |
3 | 6 |
Prebavni sistem | ||
Zaprtje |
3 | 5 |
Bruhanje |
2 | 3 |
Mišično-skeletni sistem | ||
Bolečine v hrbtu |
2 | 3 |
Psihiatrične motnje | ||
Zmeda |
5 | 6 |
Zaspanost |
2 | 3 |
Hallucinacija |
2 | 3 |
Dihalni sistem | ||
Kašelj |
3 | 4 |
Dispneja |
1 | 2 |
Drugi neželeni dogodki, ki so se pojavili z vsaj 2% incidenco pri bolnikih, zdravljenih z zdravilom Namenda, vendar z večjo ali enako hitrostjo pri placebu, so bili vznemirjenost, padec, poškodba, urinska inkontinenca, driska, bronhitis, nespečnost, okužba sečil, gripi podobni simptomi, nenormalna hoja, depresija, okužba zgornjih dihalnih poti, tesnoba, periferni edem, slabost, anoreksija in artralgija.
Skupni profil neželenih dogodkov in stopnja pojavnosti za posamezne neželene učinke pri subpopulaciji bolnikov zmerna do huda Alzheimerjeva bolezen se ni razlikovala od zgoraj opisanega profila in stopnje pojavnosti za celotno demenco populacija.
Spremembe vitalnega znaka: Skupine namenda in placeba so primerjale glede na (1) povprečno spremembo izhodiščne vrednosti življenjskih znakov (pulz, sistolični krvni tlak, diastolična kri pritisk in teža) in (2) pojavnost pacientov, ki izpolnjujejo merila za potencialno klinično pomembne spremembe glede na izhodišče pri teh spremenljivk. Klinično pomembnih sprememb vitalnih znakov pri bolnikih, zdravljenih z zdravilom Namenda, ni bilo. Primerjava meritev vitalnega znaka supine in stoječih znamenj pri Namendi in placebu pri starejših normalnih osebah je pokazala, da zdravljenje z zdravilom Namenda ni povezano z ortostatskimi spremembami.
Laboratorijske spremembe: Skupine namenda in placeba so primerjale glede na (1) povprečno spremembo glede na izhodišče v različnih kemijah seruma, hematologiji in spremenljivke urina in (2) pogostnost bolnikov, ki izpolnjujejo merila za potencialno klinično pomembne spremembe pri teh spremenljivk. Te analize niso pokazale klinično pomembnih sprememb v laboratorijskih preskusnih parametrih, povezanih z zdravljenjem z zdravilom Namenda.
Spremembe EKG-ja: Skupine namenda in placeba so bile primerjane glede na (1) povprečno spremembo glede na izhodišče v različnih parametrih EKG in (2) pojavnost pacientov, ki izpolnjujejo merila za potencialno klinično pomembne spremembe od teh pri njihovem spremenljivk. Te analize niso pokazale klinično pomembnih sprememb parametrov EKG, povezanih z zdravljenjem z zdravilom Namenda.
Drugi neželeni dogodki, opaženi med kliničnimi preskušanji
Zdravilo Namenda je bilo uporabljeno pri približno 1350 bolnikih z demenco, od katerih je več kot 1200 prejemalo največji priporočeni odmerek 20 mg na dan. Bolniki so prejemali zdravilo Namenda v obdobju do 884 dni, pri čemer je 862 bolnikov prejemalo vsaj 24 tednov zdravljenja in 387 bolnikov, ki so prejemali 48 tednov ali več.
Znaki in simptomi zdravljenja, ki so se pojavili med 8 kontroliranimi kliničnimi preskušanji in 4 odprtimi zdravili klinični preiskovalci so klinične preiskovalce zabeležili kot neželene učinke z uporabo lastne terminologije izbira. Da bi zagotovili splošno oceno deleža posameznikov, ki imajo podobne vrste dogodkov, so bili dogodki združeni v manjše število standardiziranih kategorij z uporabo terminologije WHO in pogostosti dogodkov so bile izračunane za vse študije.
Vključeni so vsi neželeni dogodki pri vsaj dveh bolnikih, razen tistih, ki so že navedeni v tabeli 1, tudi izrazi WHO splošno so informativne narave, manjši simptomi ali dogodki, ki verjetno ne bodo povzročili drog, npr. ker so v raziskavi pogosti populacija. Dogodki so razvrščeni po telesnem sistemu in navedeni z naslednjimi opredelitvami: pogosti neželeni dogodki - dogodki pri vsaj 1/100 bolnikov; redki neželeni učinki - tisti, ki se pojavijo pri 1/100 do 1/1000 bolnikov. Ti neželeni učinki niso nujno povezani z zdravljenjem z zdravilom Namenda in so bili v večini primerov v nadzorovanih študijah opaženi podobno pogosto pri bolnikih, ki so prejemali placebo.
Telo kot celota: Pogosto: sinkopa. Redko: hipotermija, alergijska reakcija.
Srčnožilni sistem: Pogosto: srčno popuščanje. Redko: angina pektoris, bradikardija, miokardni infarkt, tromboflebitis, atrijska fibrilacija, hipotenzija, srčni zastoj, posturalna hipotenzija, pljučna embolija, pljučni edem.
Centralni in periferni živčni sistem: Pogosti: prehodni ishemični napad, cerebrovaskularna nesreča, vrtoglavica, ataksija, hipokinezija. Redko: parestezija, konvulzije, ekstrapiramidna motnja, hipertonija, tremor, afazija, hipoestezija, nenormalno koordinacija, hemiplegija, hiperkinezija, neprostovoljno krčenje mišic, stupor, možganska krvavitev, nevralgija, ptoza, nevropatija.
Prebavni sistem: Redko: gastroenteritis, divertikulitis, krvavitve iz prebavil, melena, razjede požiralnika.
Hemične in limfne motnje: Pogoste: anemija. Redko: levkopenija.
Presnovne in prehranske motnje: Pogosto: povečana alkalna e fosfataza, zmanjšana teža. Redko: dehidracija, hiponatremija, poslabšan diabetes mellitus.
Psihiatrične motnje: Pogosto: agresivna reakcija. Redko: blodnja, motnja osebnosti, čustvena labilnost, živčnost, motnja spanja, povečan libido, psihoza, amnezija, apatija, paranoidna reakcija, nenormalno razmišljanje, nenormalno jokanje, povečan apetit, paronirija, delirij, depersonalizacija, nevroza, samomor poskus.
Dihalni sistem: Pogoste: pljučnica. Redko: apneja, astma, hemoptiza.
Koža in dodatki: Pogoste: izpuščaji. Redko: razjeda na koži, srbenje, celulitis, ekcem, dermatitis, eritematozni izpuščaji, alopecija, urtikarija.
Posebna čutila: Pogoste: katarakta, konjunktivitis. Redko: degeneracija makule lutee, zmanjšana ostrina vida, zmanjšan sluh, tinitus, blefaritis, zamegljen vid, motnost roženice, glavkom, konjunktivna krvavitev, bolečine v očeh, krvavitve mrežnice, kseroftalmija, diplopija, nenormalno solzenje, miopija, odvajanje mrežnice.
Urinarni sistem: Pogosto: pogosto mokrenje. Redko: disurija, hematurija, zastajanje urina.
Dogodki, prijavljeni po trženju podjetja Namenda, tako v ZDA kot v ZDA
Čeprav niso ugotovili vzročne zveze z zdravljenjem z memantinom, so poročali, da so naslednji neželeni učinki časovno povezani z zdravljenjem z memantinom in niso opisano drugje pri označevanju: atrioventrikularni blok, zlom kosti, sindrom karpalnega kanala, možganski infarkt, bolečine v prsnem košu, klavdikacija, kolitis, diskinezija, disfagija, gastritis, gastroezofagealni refluks, velike mal konvulzije, intrakranialna krvavitev, jetrna odpoved, hiperlipidemija, hipoglikemija, ileus, impotenca, slabo počutje, nevroleptični maligni sindrom, akutna pankreatitis, aspiracijska pljučnica, akutna odpoved ledvic, podaljšan interval QT, nemir, Stevens-Johnsonov sindrom, nenadna smrt, supraventrikularna tahikardija, tahikardija, tardivna diskinezija in trombocitopenija.
TOKSIKOLOGIJA ŽIVALI
Memantijske lezije nevronov (vakuolacija in nekroza) v multipolarnih in piramidalnih celicah v kortikalnih plasteh III in IV zadnje cingulati in retrosplenialni nekortiki pri podganah, podobni tistim, za katere je znano, da se pojavljajo pri glodalcih, ki so prejeli druge antagoniste receptorjev NMDA. Lezije so bile opažene po enkratnem odmerku memantina. V študiji, v kateri so podgane 14 dni prejemale vsakodnevne peroralne odmerke memantina, je bil odmerek brez učinka na nekronsko nekrozo 6-krat večji od največjega priporočenega odmerka pri ljudeh na osnovi mg / m2. Možnost indukcije centralne nevronske vakuolacije in nekroze z antagonisti receptorjev NMDA pri ljudeh ni znana.
ZDRAVSTVO Z DROGI IN ZAVEZOVANJE
Razred nadzorovanih snovi: Memantin HCl ni nadzorovana snov.
Fizična in psihološka odvisnost: Memantin HCl je nekonkurenčen antagonist NMDA z nizko do zmerno afiniteto, ki ni predložil nobenih dokazov o iskanju drog vedenje ali odtegnitveni simptomi po prenehanju jemanja pri 2.504 bolnikih, ki so sodelovali v kliničnih preskušanjih na terapevtskih odmerki. Podatki o trženju zunaj ZDA, ki so bili zbrani retrospektivno, niso dokazali zlorabe drog ali odvisnosti od njih.
Predoziranje
Ker se strategije obvladovanja prevelikega odmerjanja nenehno razvijajo, je priporočljivo, da se obrnete na a za zatiranje zastrupitve, da bi določil najnovejša priporočila za zdravljenje prevelikega odmerka katerega koli droga.
Kot v vseh primerih prevelikega odmerjanja je treba uporabiti splošne podporne ukrepe in zdravljenje mora biti simptomatsko. Izločanje memantina se lahko poveča z zakisanjem urina. V dokumentiranem primeru prevelikega odmerjanja do 400 mg memantina je bolnik doživel nemir, psihozo, vidne halucinacije, zaspanost, stupor in izgubo zavesti. Pacient je okreval brez trajnih posledic.
Odmerjanje in uporaba
Odmerjanje zdravila Namenda (memantin hidroklorid), ki se je izkazalo za učinkovito v kontroliranih kliničnih preskušanjih, je 20 mg / dan.
Priporočeni začetni odmerek zdravila Namenda je 5 mg enkrat na dan. Priporočeni ciljni odmerek je 20 mg / dan. Odmerek je treba povečati v korakih po 5 mg na 10 mg / dan (5 mg dvakrat na dan), 15 mg / dan (5 mg in 10 mg kot ločeni odmerki) in 20 mg / dan (10 mg dvakrat na dan). Najmanjši priporočeni interval med povečanjem odmerka je en teden.
Namendo lahko jemljete s hrano ali brez nje.
Bolnike / negovalce je treba poučiti o uporabi dozirne naprave Namenda Oral Solution. Opozoriti jih morate na navodila za uporabo pacienta, ki so priloženi izdelku. Bolnike / negovalce je treba naročiti, da vsa vprašanja o uporabi raztopine naslovijo na svojega zdravnika ali farmacevta.
Odmerki v posebnih populacijah
Pri bolnikih s hudo ledvično okvaro (očistek kreatinina 5 - 29 ml / min na podlagi enačbe Cockroft-Gault) priporočamo ciljni odmerek 5 mg BID:
Za moške: CLcr = [starost 140 let (let)] · Teža (kg) / [72 · kreatinin v serumu (mg / dL)]
Za ženske: CLcr = 0,85 · [starost 140 let (let)] · Teža (kg) / [72 · kreatinin v serumu (mg / dL)]
Kako dobavljeno
5 mg tableta:
Steklenica 60 NDC # 0456-3205-60
10 — 10 enot odmerka NDC # 0456-3205-63
Filmsko obložene tablete v obliki kapsule so porjavele, na eni strani je trdnost (5), na drugi pa FL.
10 mg tableta:
Steklenica 60 NDC # 0456-3210-60
10 Ã 10 enot odmerka NDC # 0456-3210-63
Filmsko obložene tablete v obliki kapsule so sive, z vtisnjeno trdnostjo (10) na eni strani in FL na drugi strani.
Titracija Pak:
Pretisni omot iz PVC / aluminija, ki vsebuje 49 tablet. 28 mg 5 mg in 21 mg 10 mg tablete. NDC # 0456-3200-14
Filmsko obložene tablete v obliki kapsule v obliki kapsule so porjavele, z močjo (5) na eni strani in FL na drugi strani. Filmsko obložene tablete v obliki kapsule v obliki kapsule so sive, z močjo (10) na eni strani in FL na drugi strani.
Ustna rešitev:
Priporočila za odmerjanje peroralne raztopine so enaka priporočilom za tablete. Peroralna raztopina je bistra, brez alkohola, brez sladkorja in poprove mete.
2 mg / ml peroralne raztopine (10 mg = 5 ml)
12 fl. oz. (360 ml) steklenica NDC # 0456-3202-12
Shranjujte pri 25 ° C; dovoljeni izleti do 15-30 ° C (glej USP nadzorovana temperatura prostora).
Forest Pharmaceuticals, Inc.
Hčerinsko podjetje Forest Laboratories, Inc.
St. Louis, MO 63045
Licencirano pri Merz Pharmaceuticals GmbH
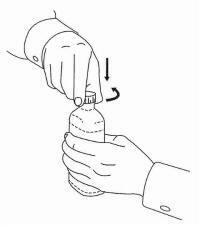
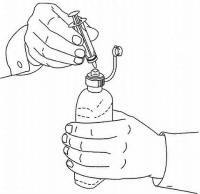
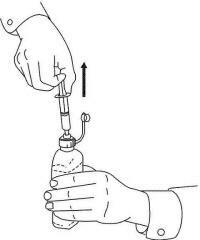
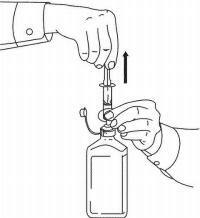
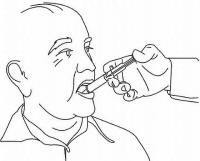
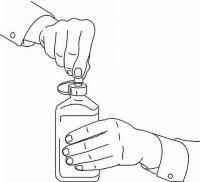
NAVODILA ZA BOLEČINE ZA peroralno raztopino NAMENDA®
Sledite spodnjim navodilom za uporabo naprave za odmerjanje Namenda® Oral Solution.
POMEMBNO: Pred uporabo oralne rešitve Namenda® preberite ta navodila.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
POMEMBNO: Informacije v tej monografiji ne zajemajo vseh možnih načinov uporabe, navodil, previdnostnih ukrepov, interakcij z zdravili ali škodljivih učinkov. Te informacije so posplošene in niso mišljene kot poseben zdravniški nasvet. Če imate vprašanja o zdravilih, ki jih jemljete ali bi želeli več informacij, se posvetujte s svojim zdravnikom, farmacevtom ali medicinsko sestro. Nazadnje posodobljeno 4.07.
Vir: Forest Laboratories, ameriški distributer podjetja Namenda.
Podatki o bolniku Namenda (v običajni angleščini)
nazaj k: Domača stran Psihiatrična zdravila

